寡孢节丛孢(Arthrobotrys oligospora) 是一种典型的捕食线虫真菌,也是研究真菌和线虫互作的模式真菌。2023年8月7日,云南大学张克勤院士团队杨金奎课题组在Cell Press细胞出版社旗下交叉学科期刊iScience上发表了题为“Fus3 regulates asexual development and trap morphogenesis in the nematode-trapping fungus Arthrobotrys oligospora”的研究论文,作者采用表型比较和多组学分析等技术对寡孢节丛孢中Fus3的功能和调控网络进行了分析,①Fus3在细胞融合、捕器形态发生和线虫捕食中起着不可或缺的作用;②Fus3调控菌丝发育、分生孢子形成、应激反应、DNA损伤、自噬和次级代谢;③基于转录组分析构建了Fus3的调控网络。该研究深入探讨了Fus3在捕食线虫真菌无性发育和致病性中的功能和调控机制,为高效线虫生防菌株的研发奠定基础。
相关背景
丝裂原活化蛋白激酶 (MAPK) Fus3是植物和动物病原真菌细胞分化和毒力的重要调节因子。然而,MAPK信号在捕食线虫真菌 (nematode-trapping fungi) 中的功能和调节机制仍然不清楚。捕食线虫真菌可以形成精巧的捕食器官 (捕器) 捕杀线虫,捕器的形成和形态发育与真菌的捕食能力密切相关,也是真菌从腐生生活转变为捕食生活方式的重要标志。寡孢节孢菌 (A. oligospora) 是一种代表性的捕食线虫真菌,能够产生粘性三维菌网捕器捕杀线虫,目前对于捕食线虫真菌捕器的形态发育调控机制尚不清楚。本文采用基因敲除、表型比较、转录组、代谢组和酵母双杂交等技术对Fus3在寡孢节丛孢的生长发育和捕器形成过程中的功能和调控机制进行了探讨。
结果解读
1、Fus3调节菌丝生长、细胞核数量和内吞作用
不同真菌来源的Fus3的蛋白序列非常保守,寡孢节丛孢的Fus3与其它丝状真菌的同源蛋白序列相似性高达90%以上,与酿酒酵母的序列相似性为60.3%。通过同源重组的方法对该基因进行了敲除并获得Δfus3突变菌株。表型比较发现,与野生型 (Wild-type, WT) 菌株相比,Δfus3突变菌株的菌落生长缓慢,菌丝中细胞隔膜增多,菌丝的长度变短;菌丝细胞中的细胞核数目减少;同时菌丝细胞的内吞现象减弱 (图1)。
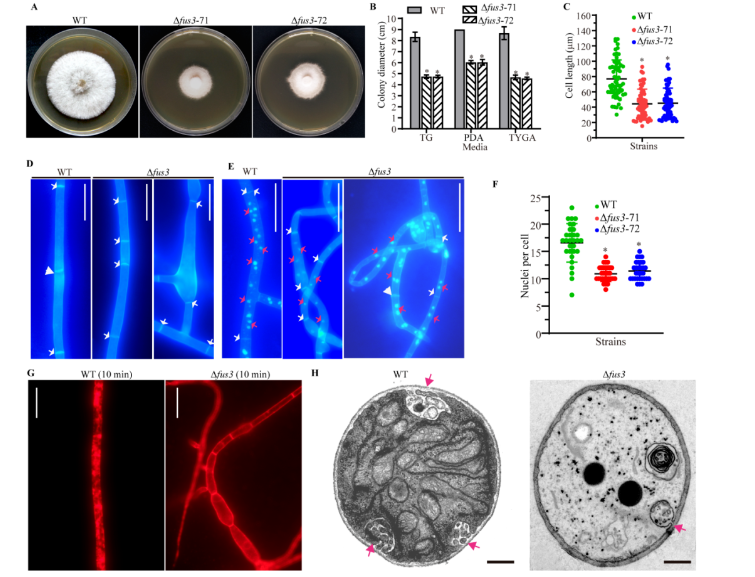
图1. WT和Δfus3突变菌株的菌丝生长、菌丝隔膜、细胞核和内吞比较
2、Fus3调节分生孢子梗发育和分生孢子产量
通过侧拍发现与WT菌株相比,Δfus3突变菌株的的分生孢子梗变得稀疏,分生孢子的数量显著减少;进一步对分生孢子梗和孢子的形态进行观察,发现WT菌株分生孢子梗顶端着生多个分生孢子,而Δfus3突变菌株分生孢子梗顶端只有1-2个孢子。同时多数突变菌株分生孢子的形态发生改变,细胞核数量减少。实时荧光定量 PCR检测发现,Δfus3突变菌株中abaA等核心产孢调控基因的转录水平显著下调。此外,转录组分析发现Δfus3突变菌株中14个参与有丝分裂和细胞周期的基因转录水平下调,abaA、brlA、wetA和stuA等核心产孢基因的转录水平也下调 (图2)。
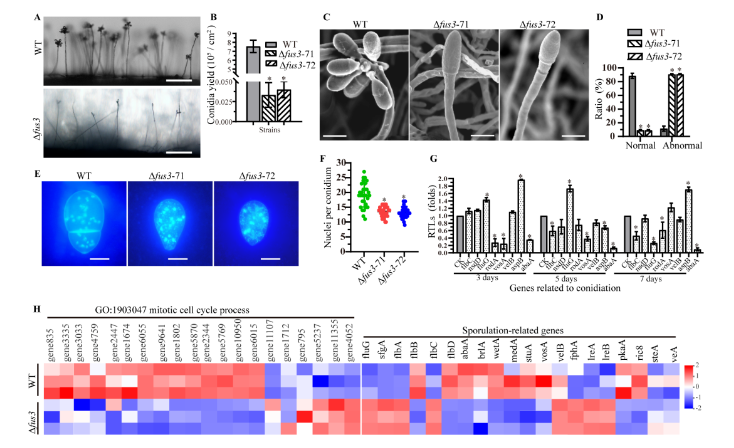
图2. WT和Δfus3突变菌株的产孢相关基因转录水平比较
3、Fus3调节细胞融合、捕器形态发生和致病性
细胞融合对于菌落形态的发育和细胞间信号及物质的交换具有非常重要的作用。在WT菌株孢子萌发和营养生长期间都可以观察到细胞融合现象,而在Δfus3突变菌株中没有观察到细胞融合的现象。通过扫描电子显微镜观察线虫诱导48小时后各菌株所产生的捕器形态,发现WT菌株通过细胞融合产生许多包含多个菌丝环的三维菌网,并且大部分的线虫被捕获和消化。然而,由于细胞融合减少,Δfus3突变菌株无法产生典型的捕器,仅产生了少量的菌丝圈,只能捕获少量的线虫。此外,通过透射电子显微镜 (TEM) 观察发现WT菌株产生的捕器细胞含有许多电子致密体 (electron-dense bodies,EDs),而Δfus3突变菌株菌丝圈细胞中的EDs数量减少。通过比较捕器和菌丝圈的数量,发现Δfus3突变菌株在线虫诱导24和36小时后产生的菌丝圈数量显著少于WT菌株产生的捕器数量。相应地,Δfus3突变菌株捕食线虫的能力也显著低于WT菌株 (图3)。
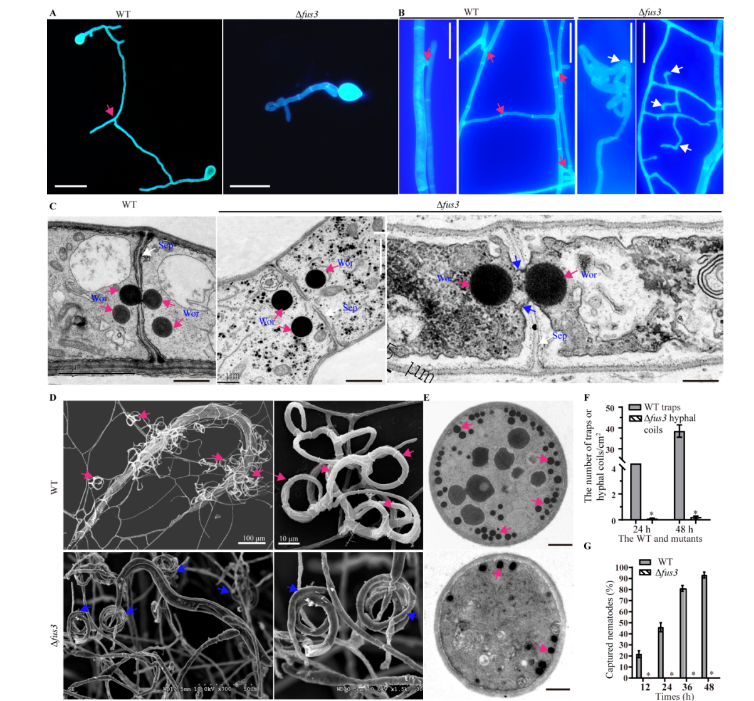
图3. WT和Δfus3突变菌株的细胞融合、捕器形成和杀线虫活性的比较
4、Fus3调节DNA损伤修复和线粒体自噬
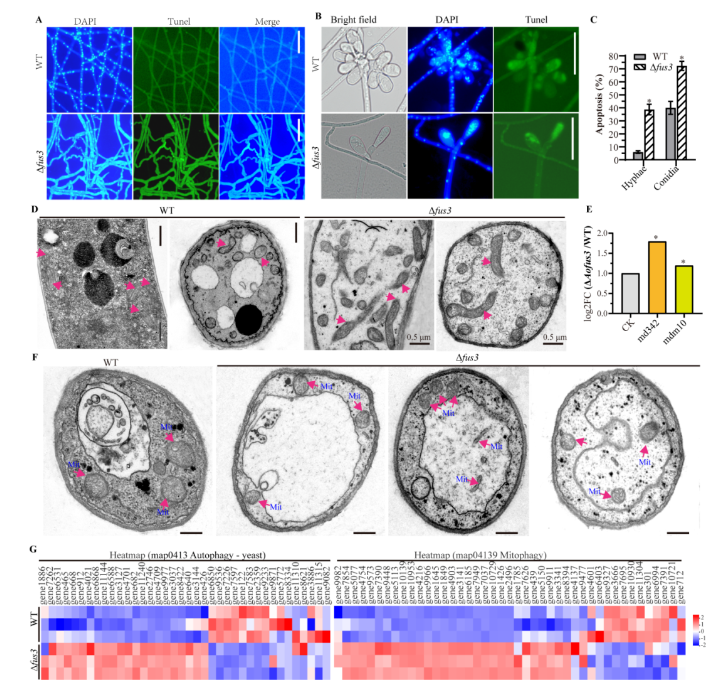
采用末端脱氧核苷酸转移酶介导的dUTP缺口末端标记 (TUNEL) 技术测定菌丝和孢子中的DNA损伤情况,发现与WT菌株相比,Δfus3突变菌株菌丝和孢子中的DNA片段化增加。TEM观察发现Δfus3突变菌株中线粒体变形,线粒体分布和形态相关基因 (md342和mdm10) 的转录水平与WT相比升高。在饥饿条件下,Δfus3突变菌株的液泡明显增大,存在明显的线粒体自噬。此外,通过聚类热图分析发现,Δfus3突变菌株中参与自噬和线粒体自噬相关基因的转录水平与WT菌株相比发生了显著变化 (图4)。
图4. WT和Δfus3菌株菌丝中DNA损伤、线粒体形态和自噬比较
5、菌丝生长、捕器形成和捕食过程的转录组学分析
通过RNA测序技术比较了WT和Δfus3突变菌株的转录谱。在菌丝营养生长期间,与WT菌株相比,Δfus3突变菌株分别有2,200和1,564个差异表达基因 (DEGs)。GO富集分析发现,上调的DEGs主要参与RNA加工、蛋白酶体蛋白代谢、肌动蛋白聚合或解聚、葡聚糖生物合成和细胞器膜构件等。下调的DEGs主要参与葡萄糖代谢、羧酸分解代谢、金属离子转运、翻译、核苷代谢、凋亡过程的负调控、核糖核苷和丙酸代谢等过程。进一步的 KEGG富集分析发现,DEGs主要参与蛋白质合成和加工 (核糖体、RNA转运和蛋白质输出)、能量 (糖酵解/糖异生、柠檬酸循环和乙醛酸和二羧酸代谢)、自噬过程 (自噬、线粒体自噬和噬体)、氧化磷酸化、MAPK信号、细胞周期、内吞作用、过氧化物酶体和蛋白酶体等 (图 5)。
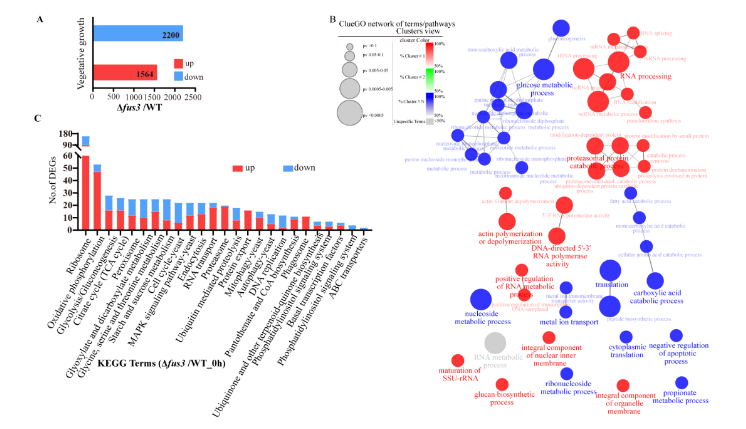
图5. WT和Δfus3 突变菌株在菌丝营养生长阶段转录谱的比较
在捕器形成和线虫捕食阶段,Δfus3突变菌株在线虫诱导12,24 和 36 h时分别有1984、1974和1917个基因上调,2082、1733和1271个基因下调。此外,与WT相比,Δfus3突变菌株在线虫诱导12、24和36 h时对线虫响应的基因分别占41.8% (1698/4066)、26.2% (972/3707) 和23.5% (749/3188)。在这些DEGs中,与DNA转录模板调控、细胞内蛋白质转运、钙离子转运调控、通过小蛋白结合或去除修饰蛋白质以及磷脂酰肌醇去磷酸化相关的DEGs在12 h显著富集;参与嘌呤核苷三磷酸代谢过程、有丝分裂DNA完整性检查点信号、DNA代谢、肽生物合成,核苷酸-糖生物合成等在24 h显著富集;参与四氢叶酸和蛋氨酸代谢、铵跨膜转运蛋白活性、糖醇代谢、葡聚糖生物合成和细胞葡聚糖代谢过程在36 h富集。此外,在三个时间点共表达的974基因参与了脂肪酸生物合成、脱氧核糖核酸酶活性、端粒维持、甾醇代谢、肌动蛋白丝聚合的负调控、DNA 连接酶活性、羧肽酶活性、硝酸盐同化和γ -氨基丁酸代谢过程。进一步的 KEGG 富集分析表明,RNA转运、蛋白酶体、过氧化物酶体、乙醛酸和二羧酸代谢,以及囊泡运输途径在12 h时显著富集;核糖体、氧化磷酸化、错配修复和硫胺素代谢途径在24 h显著富集;淀粉和蔗糖代谢以及甲烷代谢途径在36 h显著富集 (图6)。
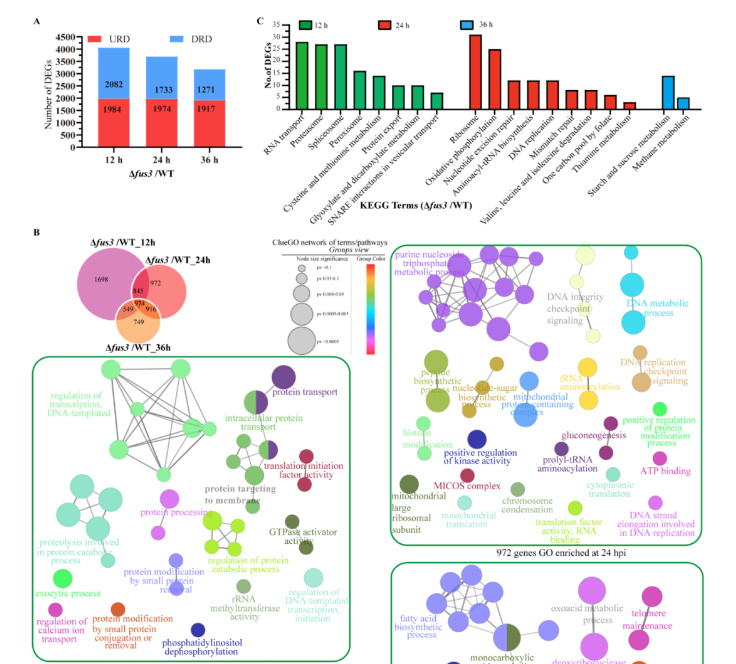
图6. 捕器形成和捕食阶段WT和Δfus3突变菌株的转录谱比较
7、Fus3参与次级代谢产物调控
通过液相色谱-质谱法比较WT和Δfus3突变菌株发酵液中的化合物差异。火山图分析显示,与WT相比,Δfus3突变菌株中有2,344种化合物上调,2,912种化合物下调。Δfus3突变菌株的化合物峰在色谱图中的多个保留时间点与WT显著不同。此外,与WT相比,Δfus3突变菌株中的寡孢素 (arthrobotrisins) 的峰面积减小。同时,Δfus3突变菌株中与寡孢素生物合成相关的AOL_s00215g基因簇中相关基因的转录水平在菌丝营养生长期下调 (图7)。
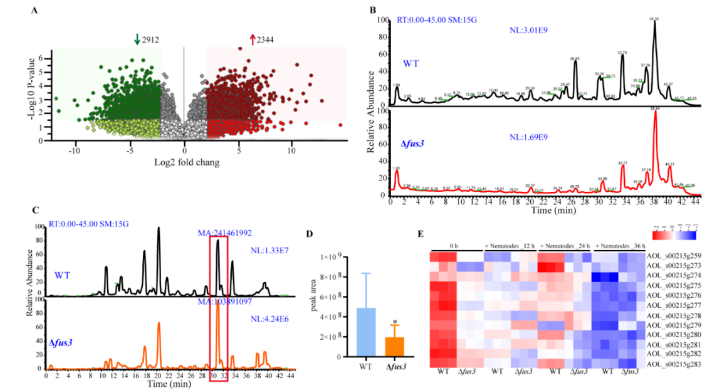
图7. WT和Δfus3突变菌株的代谢谱分析和比较
8、Fus3互作网络分析、互作蛋白预测和验证
在表型比较的基础上,结合转录组分析,筛选出与细胞通讯、转录因子、细胞周期、翻译、细胞应激反应、营养代谢和孢子形成相关基因,以及文献报道与 Fus3互作的基因,如Far11、Cdc24、Cdc42和COA,共278个基因。通过STRING网站对278个基因的相互作用进行预测,使用Cytoscape软件作图。发现与Fus3互作的这些基因主要参与MAPK信号通路、细胞周期、减数分裂、转录因子、核苷酸切除修复、DNA复制、泛素介导的蛋白水解、错配修复、同源重组、非同源末端连接和碱基切除修复。使用ClueGo进一步对参与细胞通讯的基因进行分析,发现它们主要参与对细胞外刺激的反应、信号转导的调节、细胞过程的调节、线粒体跨膜转运、钙离子转运调节、信号肽加工、膜融合和细胞形态发生等过程。此外,利用酵母双杂交技术验证发现Fus3与转录因子Ste12、发育调控因子FlbA、蛋白酪氨酸磷酸酶Pyp1和Ptp直接互作 (图 8)。
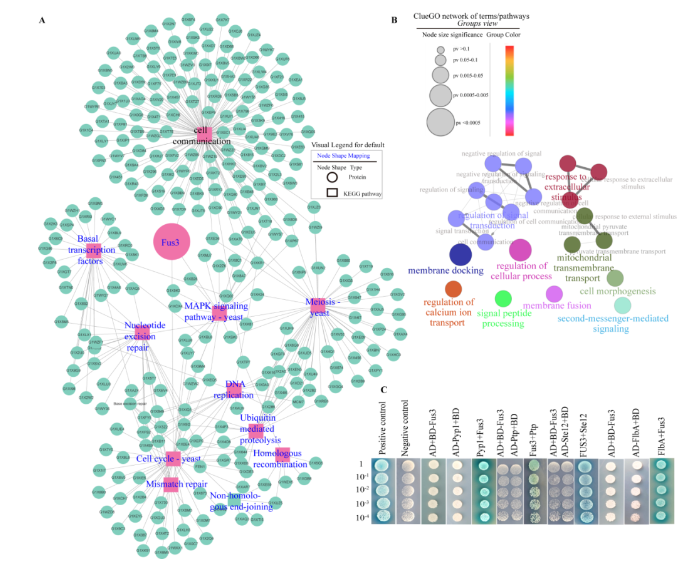
图8. Fus3互作网络和靶基因分析及酵母双杂交验证
总结
本文的研究发现Fus3-MAPK信号对寡孢节丛孢的细胞融合、捕器形态发生和致病性必不可少,并在菌丝生长发育、分生孢子形成、应激反应、DNA 损伤、自噬和次级代谢中发挥重要的调控作用。此外,Fus3的调控网络分析表明,它可以通过参与蛋白质合成与加工、自噬、氧化磷酸化、细胞周期、过氧化物酶体和蛋白酶体等调控相关表型。本文的研究揭示了Fus3-MAPK信号在捕食线虫真菌的菌丝发育和捕器形成过程中发挥的功能和调控网络,为进一步阐明细胞融合、捕器形态发育和生活史转换的调控机制奠定了基础。

