肿瘤发生发展与胚胎发育过程存在很多相似性。这提示我们可以利用发育生物学的角度来解决肿瘤生物学的基本问题,并为癌症的诊断和治疗提供新的思路。胚胎滞育是一种独特的生物学现象,是许多哺乳动物面对恶劣环境时选择的一种通过可逆地阻滞胚胎发育,以提高繁殖适合度的生存策略。近期有研究报道称,在肿瘤细胞面对化疗药物时,肿瘤细胞会进入了类似滞育的状态1,2。然而,肿瘤细胞如何转变为滞育样状态(缓慢增殖,对化疗抵抗)以及建立、寻找这类细胞的生物标志物仍需深入研究。
研究人员首先通过滞育相关的多数据整合,包括肿瘤细胞营养匮乏,化疗后肿瘤组织和小鼠滞育胚胎等1,3,发现SMC4的下调在多种滞育相关事件中普遍存在。这提示SMC4可能是调控肿瘤细胞滞育样状态的关键因子。随后研究者针对SMC4进行敲低及可诱导敲低,通过转录组富集分析,药物敏感性测定,肿瘤细胞3D培养和荷瘤小鼠等实验模型与手段,证实SMC4下调后,肿瘤细胞增殖能力下降,对药物抵抗能力增强,存在与滞育胚胎相似的转录模式并且该现象存在可逆性。这些结果表明SMC4可以调控肿瘤细胞滞育样状态。
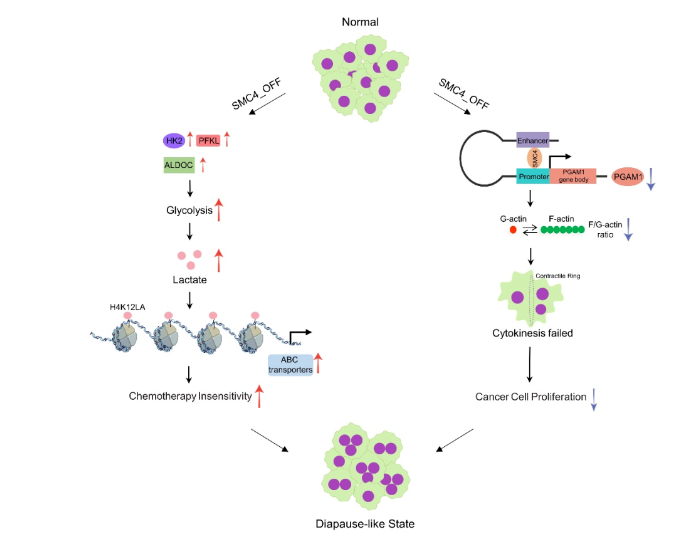
那么SMC4通过何种机制调控肿瘤细胞滞育样状态?之前有文献报道,滞育胚胎有着高糖酵解水平3。研究者首先分析MC38皮下肿瘤组织的单细胞数据发现,SMC4主要在快速增殖的肿瘤细胞中表达。但有趣的是,与其他缓慢增殖细胞相比,有缺氧特征的缓慢增殖的肿瘤细胞显示出更低的SMC4表达。并且该细胞群具有更高的糖酵解得分和胚胎滞育得分。这提示有SMC4下调诱导的滞育样肿瘤细胞(diapause-like cancer cells, DLCC)相较于一般肿瘤细胞存在更高水平的糖酵解。随后研究者通过Seahorse,葡萄糖摄取和乳酸检测等手段发现SMC4下调确实驱动糖酵解水平上升。同时发现这是由于糖酵解代谢酶HK2, PFKL和ALDOC表达上调引起的。进一步通过体内和体外实验证实加入糖酵解抑制剂2-DG和LDH抑制剂 Oxamate, DLCC表现的药物抵抗性被逆转。这说明DLCC的药物抵抗能力是由细胞高糖酵解、高乳酸水平带来的。
乳酸通过新型表观遗传修饰——乳酰化广泛参与各种生理,病理过程4。而DLCC对药物抵抗依赖于乳酸的水平,因此DLCC的高糖酵解水平是否通过乳酰化贡献于其药物抵抗能力?研究者发现SMC4下调时,肿瘤细胞泛乳酰化水平的大量增加并且H4K12位点的乳酰化修饰水平变化最为显著。接着研究者采用 CUT&TAG 技术和转录组联合分析,发现在一些负责药物泵出ABC转运蛋白启动子区域H4K12la显著富集。接着作者利用qPCR和ChIP-qPCR证实,ABCC2、ABCC3和ABCC10等通过H4K12la修饰而表达上调。这揭示了DLCC是通过提升组蛋白乳酰化水平,改变耐药基因表达进而提升对药物的抵抗能力。
前面研究者证实DLCC通过乳酰化增强自身药物抵抗。但DLCC为何增殖能力下降呢?SMC4下调虽然引起代谢酶HK2,PFKL和ALDOC表达上调,但代谢酶PGAM1表达水平却是意外的下调。通过3C,qPCR, mRNA/蛋白半衰期,荧光素酶报告系统,Crispr-Cas9等技术,研究者证明SMC4远程转录调控PGAM1。PGAM1在糖代谢过程中扮演双重身份,即PGAM1一方面参与糖酵解过程,促进3-PG向2-PG的转化;另一方面,PGAM1可通过其底物3-PG抑制6PDGH酶活性从而抑制戊糖磷酸途径(pentose phosphate pathway , PPP)。研究者猜想PGAM1下调会导致PPP途径被抑制,从而影响嘌呤的从头合成,抑制细胞增殖。随后研究者证实SMC4下调会导致3-PG积累,并利用代谢流分析发现葡萄糖进入PPP途径的比例减小。但研究者通过非靶向代谢组发现,嘌呤代谢通路并没有下调反而显著上调。这与假设不符。进一步研究者发现敲低SMC4,6PDGH 酶活性约30%的下降但葡萄糖摄取增加大于2倍。这导致即使葡萄糖PPP通量受到影响,但由于整体糖代谢的来源增加,使得PPP得以维持。
那么,PGAM1下调与DLCC增殖能力下降是否存在联系?研究者通过细胞形态观察,发现DLCC细胞体积的增加并伴随多倍体现象。在胞质分裂过程中,细胞内会形成一个由丝状肌动蛋白F-actin和肌球蛋白 myosin-2以及其他结构和调节蛋白组成的收缩环5。通过免疫荧光实验和lifact探针6,发现在SMC4下调时细胞收缩环形成失败,无法进行胞质分裂。先前的研究表明PGAM1通过与α-actin 2(ACTA2)直接结合发挥非酶促功能,促进F-actin组装,从而提高F-actin与球状肌动蛋白G-actin比率7。因此研究者在DLCC中进行了PGAM1功能回补实验,结果显示与ACTA2结合区段的PGAM1截断体显著促进了F/G-actin比例的增加,并一定程度逆转了由SMC4下调导致二倍体/多倍体细胞比例失调。以上结果表明,SMC4下调导致的PGAM1表达降低通过减弱胞质分裂促成细胞的滞育样表型。
随后研究者在SMC4敲除小鼠中通过AOM/DSS诱导的结直肠原位肿瘤模型证实了SMC4下调会导致肿瘤组织对药物抵抗。最后研究者通过组织芯片与TCGA数据评估了SMC4表达状态对临床治疗的影响。根据SMC4表达与患者是否接受标准化疗对患者进行分组。值得注意的是,化疗显著提高了SMC4高表达患者的生存率,但对SMC4低表达患者生存期无明显改善。提示SMC4表达水平可能对临床治疗方案制定有一定帮助。
综上所述,该研究发现SMC4下调诱导滞育样肿瘤细胞的产生。其机制,首先SMC4下调促进了三种糖酵解酶的表达,增加乳酸产生。由此产生的高乳酸水平通过组蛋白乳酰化增加ABC转运蛋白的表达,使得肿瘤细胞对药物抵抗。另外SMC4可以远程转录调控PGAM1。SMC4和PGAM1的协同丧失会影响F-actin的组装,诱导细胞分裂失败和多倍体现象,从而抑制肿瘤细胞增殖。该研究首次揭示了调控滞育样肿瘤的关键因子SMC4,增进人们对非遗传性药物抵抗机制的理解,同时也推进了肿瘤有氧糖酵解功能的认知,并有可能为精准肿瘤治疗提供治疗策略。
中国科学技术大学附属第一医院刘连新教授和郑州大学人民医院、郑州大学医科院吴缅教授为论文通讯作者,中国科学技术大学生命科学与医学部博士后孙雪丹和中国科学技术大学微尺度国家实验室博士后何立芳为论文第一作者。
作为一名临床医生,您为何会关注滞育样肿瘤细胞?
刘连新教授:
我们知道肿瘤患者长期用药会产生耐药性,这往往是因为基因突变引起的。但事实上,肿瘤细胞在药物处理环境中存在一些固有机制对抗药物杀伤,这被称为肿瘤非遗传耐药。这种非遗传耐药能力为肿瘤细胞在药物压力下提供了"喘息机会",使得它们有足够的时间积累基因突变并形成耐药细胞。而胚胎滞育是一种动物面对恶劣环境选择的可逆地阻滞胚胎发育以提高繁殖适合度的生存策略。胚胎发育与肿瘤发生发展存在很多相似性。这促使我们思考肿瘤细胞会不会采取类似胚胎滞育的方式抵抗药物压力。而这里我们通过多数据整合筛选出SMC4参与调控肿瘤细胞滞育样状态。其下调会诱导产生滞育样肿瘤细胞并对化疗药物有更强的抵抗能力。我们认为这很可能是很多肿瘤患者治疗失败的原因。所以我们希望通过我们的这些工作能够填补该领域的一些知识空白,推动同行对该领域的探索和研究。
此项研究的相关发现有哪些重要的临床价值?
刘连新教授:
在临床治疗中,我们通常将重点放在快速增殖的肿瘤细胞上,而忽略了那些缓慢增殖的"潜伏者"。然而,这些"潜伏者"可能是治疗失败的根本原因。我们的研究发现,SMC4表达水平较低的肿瘤患者进行化疗后,其预后与未经化疗的患者相比没有明显改善,但SMC4表达水平较高的肿瘤患者进行化疗后,其预后明显改善。因此,SMC4有望成为一个新的生物标志物,可为肿瘤内科医生在用药时提供指导。另外我们后续可以开发针对靶向SMC4的药物,稳定SMC4继而与化疗药物联用,提高那些对药物不敏感人群的治疗效果。通过本研究工作,我们希望能够更好地理解肿瘤中的"潜伏者"现象,并找到新的治疗方法,以提高肿瘤患者的治疗成功率。同时,我们也希望SMC4能成为一个有用的生物标志物,为临床医生选择治疗方案提供更好的指导。
作为一位长期关注肿瘤代谢领域的专家,您认为本研究从肿瘤代谢角度来看有哪些亮点?
吴缅教授:
在20世纪20年代,德国科学家Otto Warburg发现与肝癌旁组织相比,肝癌组织耗氧量明显减少,然而葡萄糖代谢率及乳酸产生率却升高。Otto Warburg认为即使在有氧条件下,肿瘤细胞仍会优先选择糖酵解,而不是选择能够高效产能的氧化磷酸化以提供肿瘤细胞所需能量,这种现象称之为“Warburg效应”,即有氧糖酵解。肿瘤细胞为何偏好有氧糖酵解这种低效的产能方式,目前主流解释认为肿瘤细胞选择高通量的糖酵解代谢是因为它既能快速提供能量,又能提供大量各种生物大分子的合成原料,以满足肿瘤细胞的快速增殖需求。然而我们发现滞育样肿瘤细胞中的糖酵解水平与增殖能力是解耦连的,尤其是糖酵解可以通过产生乳酸这一代谢产物重塑细胞转录。这意味着肿瘤的有氧糖酵解可能具有更广泛的功能和意义,进一步推动了人们对有氧糖酵解的认识。
此外,本研究还发现SMC4可以调控糖酵解代谢酶的转录,从而通过糖酵解代谢产物乳酸的作用,影响组蛋白乳酰化水平,最终改变基因表观。这种转录-代谢-表观的研究范式开拓了肿瘤代谢领域的研究思路。
传统观点认为,代谢酶发挥催化生化代谢反应的功能。但随着研究的深入,很多代谢酶可以发挥一些非经典功能,如基因表达调控、细胞信号转导和RNA、蛋白稳态调节等。本研究发现PGAM1可以通过非酶活功能与SMC4协同作用影响胞质分裂。这有助于扩充对代谢酶非经典功能的认识。
总之,这些发现为我们对肿瘤细胞代谢的理解提供了新的视角,并有望在未来为肿瘤治疗和研究提供新的方向和策略。
您团队有何进一步的研究计划?
吴缅教授:
事实上,本研究还有许多问题有待解答。例如:SMC4是如何在各种条件下响应下调的?是否存在一个共同的信号通路。另外SMC4转录调控三种代谢酶的具体机制尚未探明。是与调控PGAM1一样的远程转录调控模式还是采用新的方式目前仍不清楚。事实上,我也发现一些区别于本研究报道的SMC4新的转录调控方式,但仍需进一步的确认。此外,除了SMC4,是否还存在其他蛋白质可以调控肿瘤滞育状态,这也是一个十分重要的问题。了解其他潜在的调控因子可以更全面地认识肿瘤滞育的调控网络。这些都是我们接下来需要解决的问题。
参考文献
1. Rehman, S. K. et al. Colorectal Cancer Cells Enter a Diapause-like DTP State to Survive Chemotherapy. Cell 184, 226-242 e221 (2021). https://doi.org:10.1016/j.cell.2020.11.018
2. Lin, Y. H. & Zhu, H. A Malignant Case of Arrested Development: Cancer Cell Dormancy Mimics Embryonic Diapause. Cancer Cell 39, 142-144 (2021). https://doi.org:10.1016/j.ccell.2021.01.013
3. Hussein, A. M. et al. Metabolic Control over mTOR-Dependent Diapause-like State. Dev Cell 52, 236-250 e237 (2020). https://doi.org:10.1016/j.devcel.2019.12.018

