人肠道病毒A71 (EV-A71)是引发手足口病的主要病原体,被认为是最严重的神经毒性肠道病毒,已成为我国主要的公共卫生威胁之一。感染EV-A71的手足口病患者可能伴有严重的神经系统并发症,个别重症可致人死亡,通常影响婴儿和5岁以下儿童。目前,尚无针对肠道病毒的特异抗病毒药物,即使中国已获批上市三种EV-A71灭活疫苗,但单价的EV-A71疫苗无法预防其他肠道病毒感染;此外,EV-A71的不断突变也降低了疫苗的有效性。这些都强调了开发有效的抗病毒药物或疫苗来对抗EV-A71感染的重要性。
虚拟筛选(Virtual Screening)借助计算机运算,在大量候选药物中识别能与特定的药物靶标结合的潜在的化合物,常用于基于结构的药物发现。基于分子对接的虚拟筛选方法将更容易消除不需要的化合物,减少新药研发的昂贵时间和金钱成本。但基于计算机辅助计算的结果往往与真实情况有所出入,有待进一步实验评价。
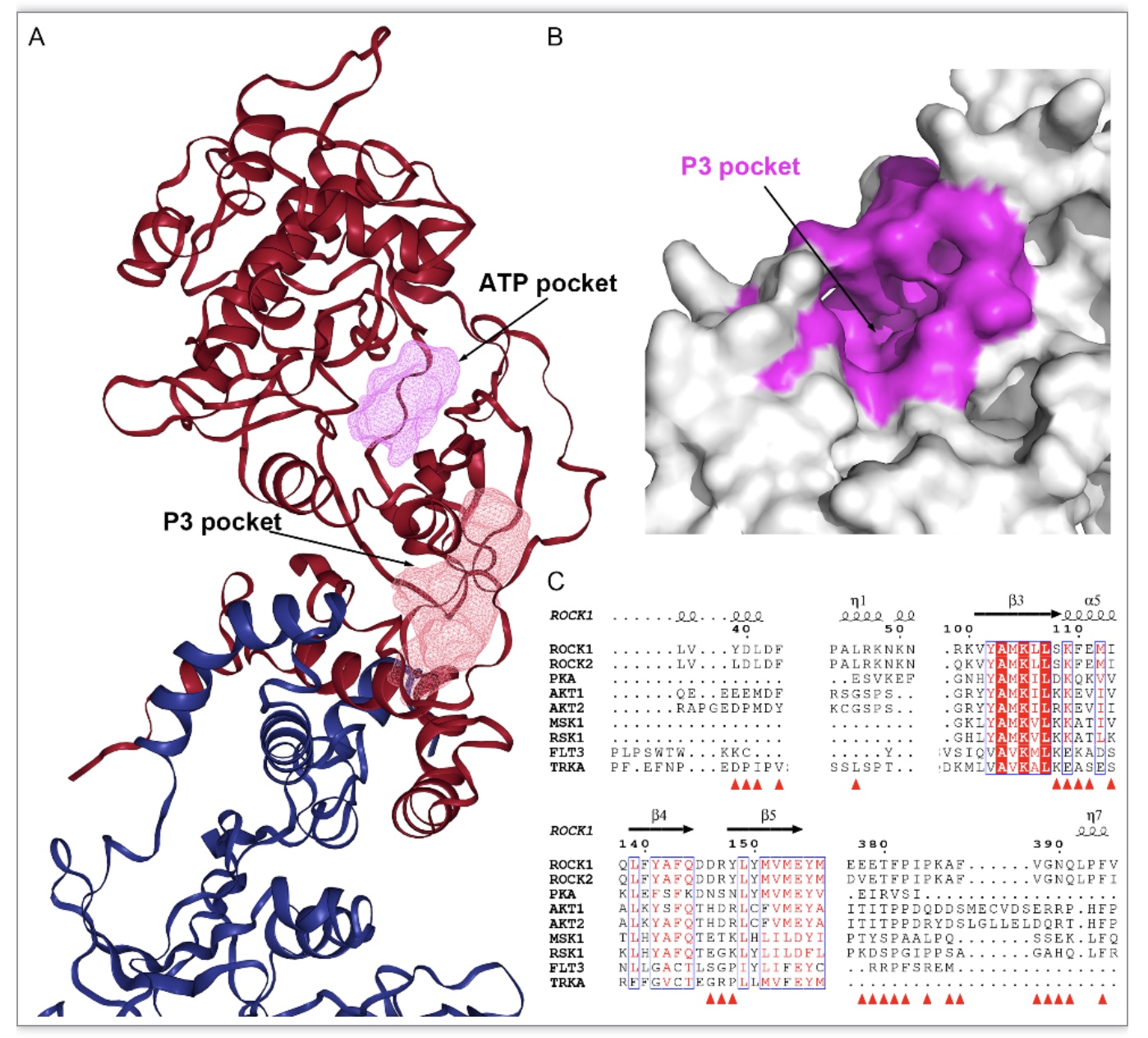
Rho相关激酶1(ROCK1)是Rho效应蛋白,可以通过磷酸化活化众多下游靶点,调整多种关键细胞功能。在前期研究中发现ROCK1是一种新型的EV-A71复制宿主依赖因子,可以作为开发抗EV-A71疗法的靶点。大量的研究发现了多种与ATP竞争的ROCK1抑制剂。首先,研究人员利用DoGSiteScorer搜寻 ROCK1的36个潜在的结合口袋,其中药物评分最高的结合口袋(以下简称P3 pocket) 位于催化活性位点(ATP结合位点)之外(图1)。研究人员进一步将ROCK1和其他激酶的多重蛋白序列比对,显示在非ROCK激酶中,大部分P3口袋残基并不保守。
图1 ROCK1的P3口袋及其口袋残基在激酶中的保守性
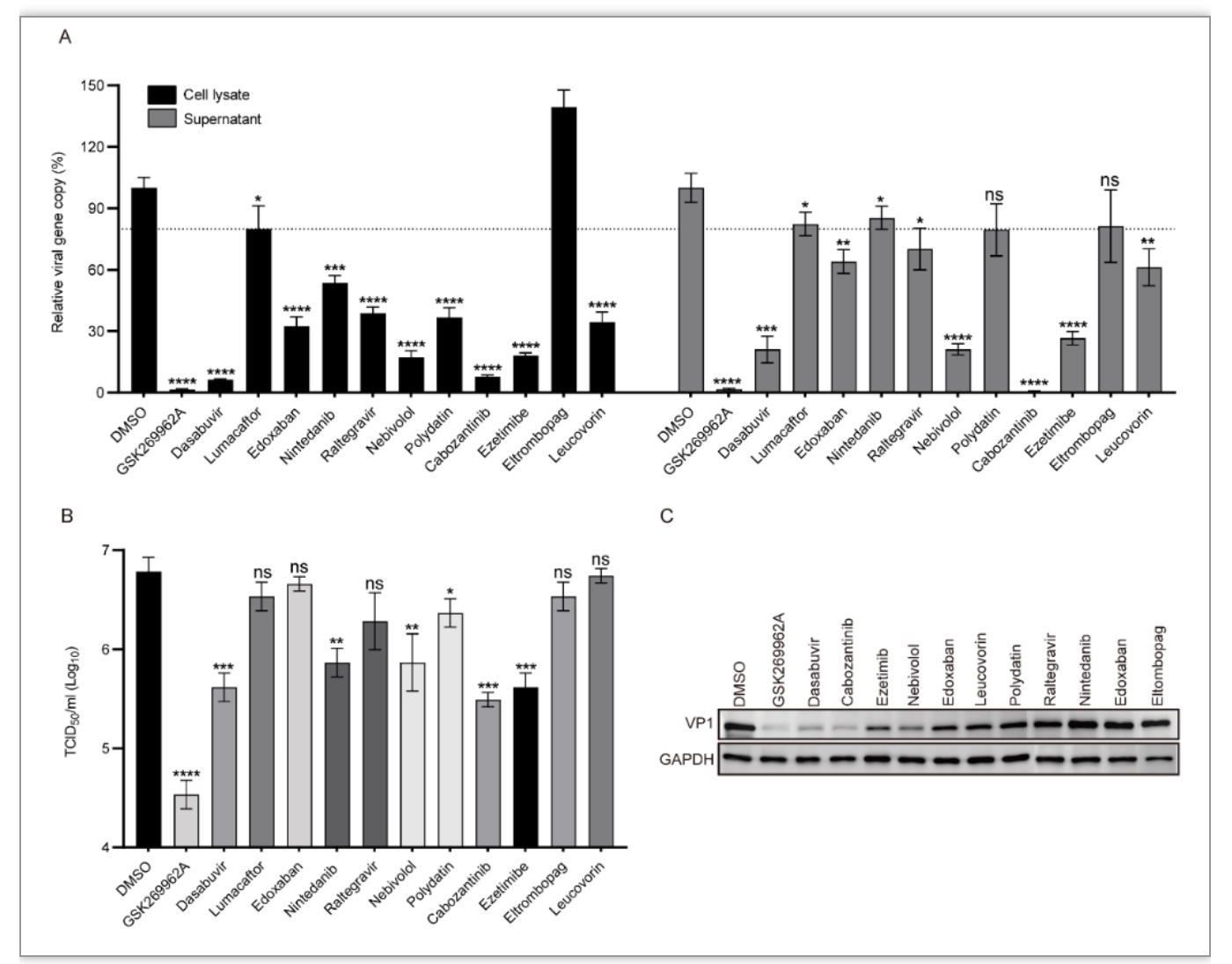
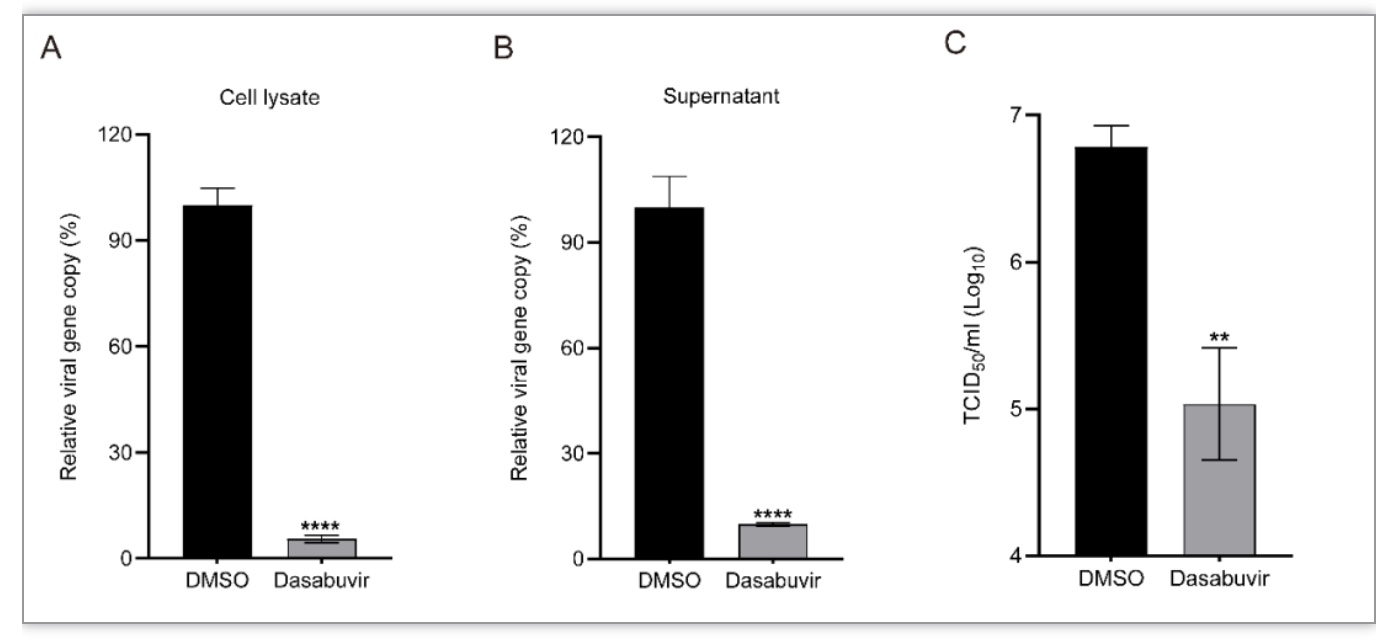
为提高对接分析的准确性,研究人员选用两种不同的对接和虚拟筛选软件:iGEMDOCK和AutoDock Vina进行基于结构的虚拟筛选。在实验中,共计1615个美国食品药品监督管理局(FDA)批准上市药物分别对接P3 pocket,共有14种药物在iGEMDOCK和AutoDock Vina的排名中均进入前100名。为了验证从虚拟筛选中选择的药物能够在细胞水平抑制了EV-A71的复制,研究人员在横纹肌肉瘤(RD)细胞中进行了病毒减少实验。在非细胞毒性浓度情况下,9个候选药物显著抑制了细胞裂解液和上清液中EV‐A71的复制,6种抑制剂Dasabuvir、依折麦布(Ezetimibe)、卡博替尼(Cabozantinib)、奈必洛尔(Nebivolol)、依度沙班(Edoxaban)和亚叶酸(Leucovorin)显著降低了病毒滴度。这些结果表明虚拟筛选得到的药物具有不同程度的抗病毒作用(图2)。其中,Dasabuvir 对EV-A71感染表现出最佳的抑制活性;与此同时,Dasabuvir在与ROCK1的对接试验中获得了最佳得分。因此,Dasabuvir因其优越的抗病毒活性而被选择作为进一步研究的对象。
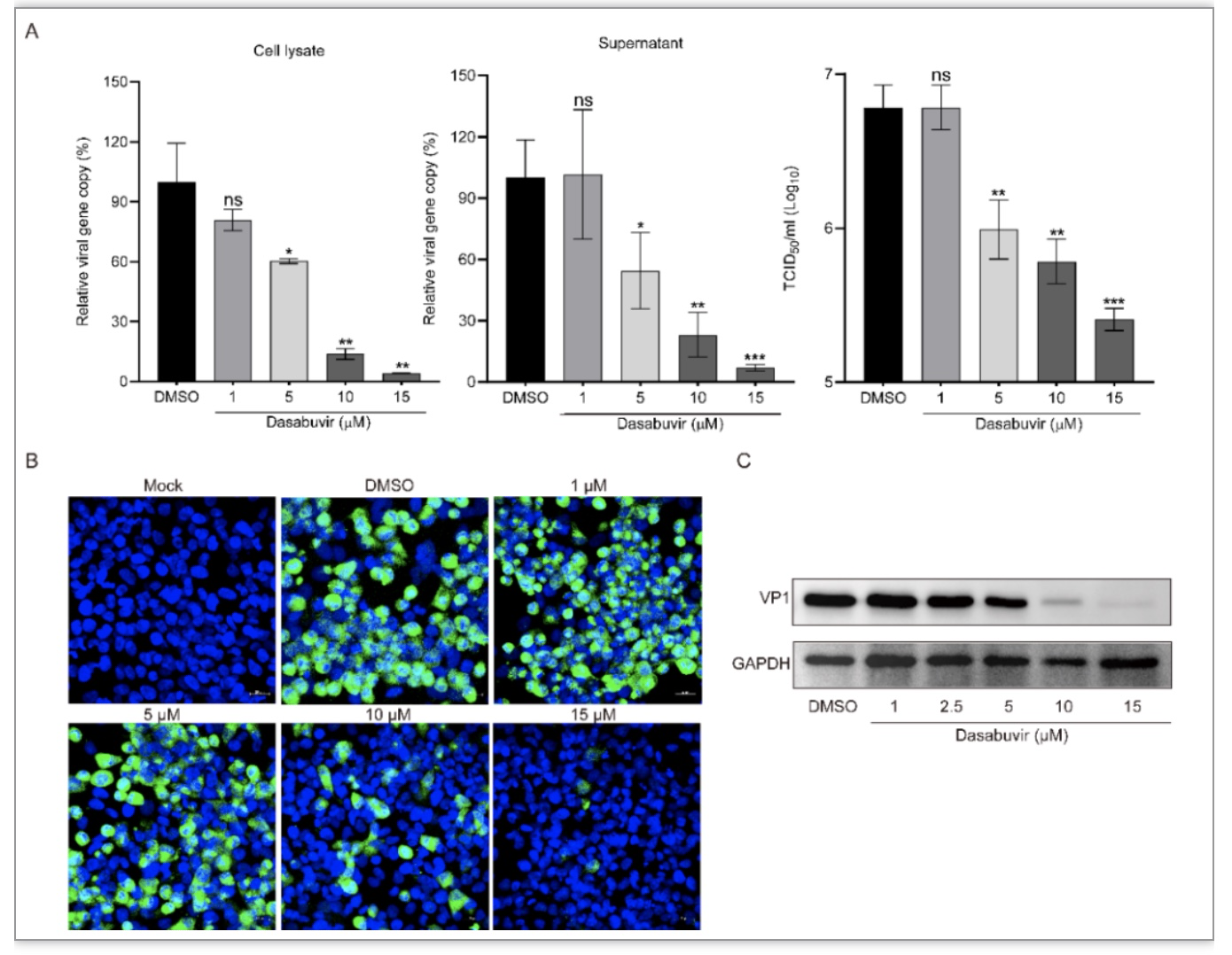
接下来,研究人员通过荧光定量PCR(qPCR)技术,病毒半数组织感染量(TCID50)试验、免疫荧光染色(Immunofluorescence staining)试验和蛋白免疫印迹(Western Blot)试验分别从病毒载量、病毒滴度、EV-A71抗原的表达情况和病毒结构蛋白表达情况,证实了Dasabuvir对EV-A71复制存在剂量依赖性抑制作用(图3)。
图3 Dasabuvir在RD细胞中以剂量依赖性方式抑制EV-A71的复制
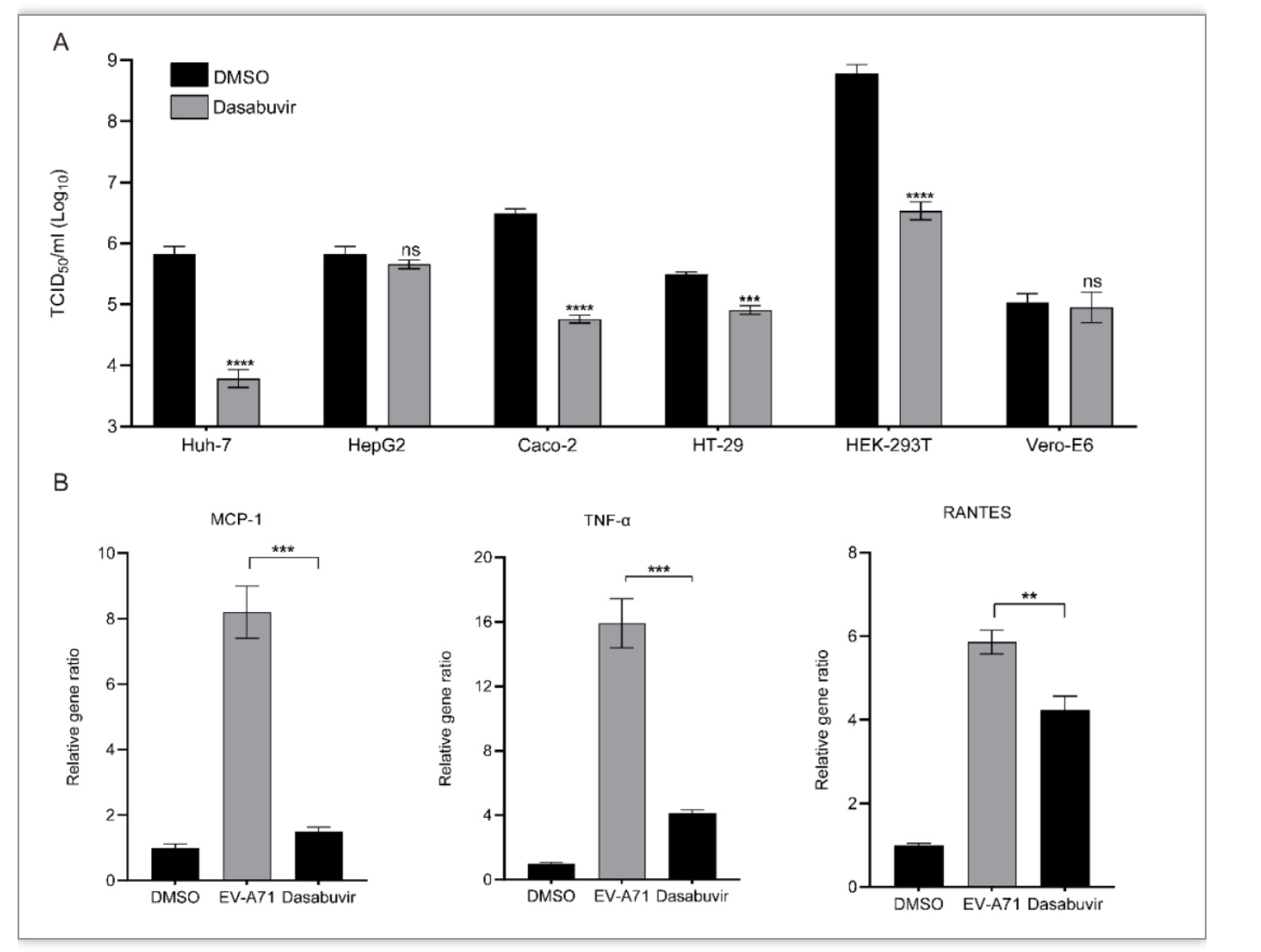
随后,研究人员利用EV-A71感染了人类和非人类来源的六种不同类型的细胞,包括Huh-7(人类肝脏)、HepG2(人类肝脏)、Caco-2(人类结肠)、HT-29(人类结肠)、HEK-293T(人类肾脏)和Vero-E6细胞(绿猴肾脏)。研究发现Dasabuvir可以显著抑制EV-A71在Huh-7、Caco-2、HT-29和HEK-293T中的复制。然而,Dasabuvir对HepG2和Vero-E6中EV-A71复制的影响微不足道。这些结果表明Dasabuvir可以抑制EV-A71在多种细胞类型中的复制(图4)。
由于严重手足口病患者通常会出现强烈的促炎反应。研究人员检测了在Dasabuvir存在与否的情况下EV-A71感染THP-1细胞中一系列关键促炎细胞因子和/或趋化因子的表达水平。结果显示,在Dasabuvir的存在下,EV-A71介导的MCP-1、TNF-α和RANTES诱导明显减弱,提示Dasabuvir可以抑制病毒诱导的促炎反应(图4)。
图4 Dasabuvir在体外对EV-A71感染发挥抗病毒作用
为了检测Dasabuvir对其他肠道病毒是否具有活性抑制的可能性,研究人员分别从肠道病毒A类和B类中选择了CVA10和柯萨奇B1(CVB1)病毒来评估Dasabuvir抗病毒活性。Dasabuvir分别在细胞裂解液和上清液中显著降低了CVA10的病毒载量。同样,培养基中的病毒滴度进一步验证了Dasabuvir显著降低了CVA10病毒复制,且表现出比对EV-A71更强的抗病毒活性。然而,未观察到Dasabuvir对CVB1复制的显著影响。综上,Dasabuvir可以抑制CVA10的复制,但不能抑制CVB1的复制,这表明Dasabuvir可能是一种针对肠道病毒A类有效的广谱抗病毒药物(图5)。
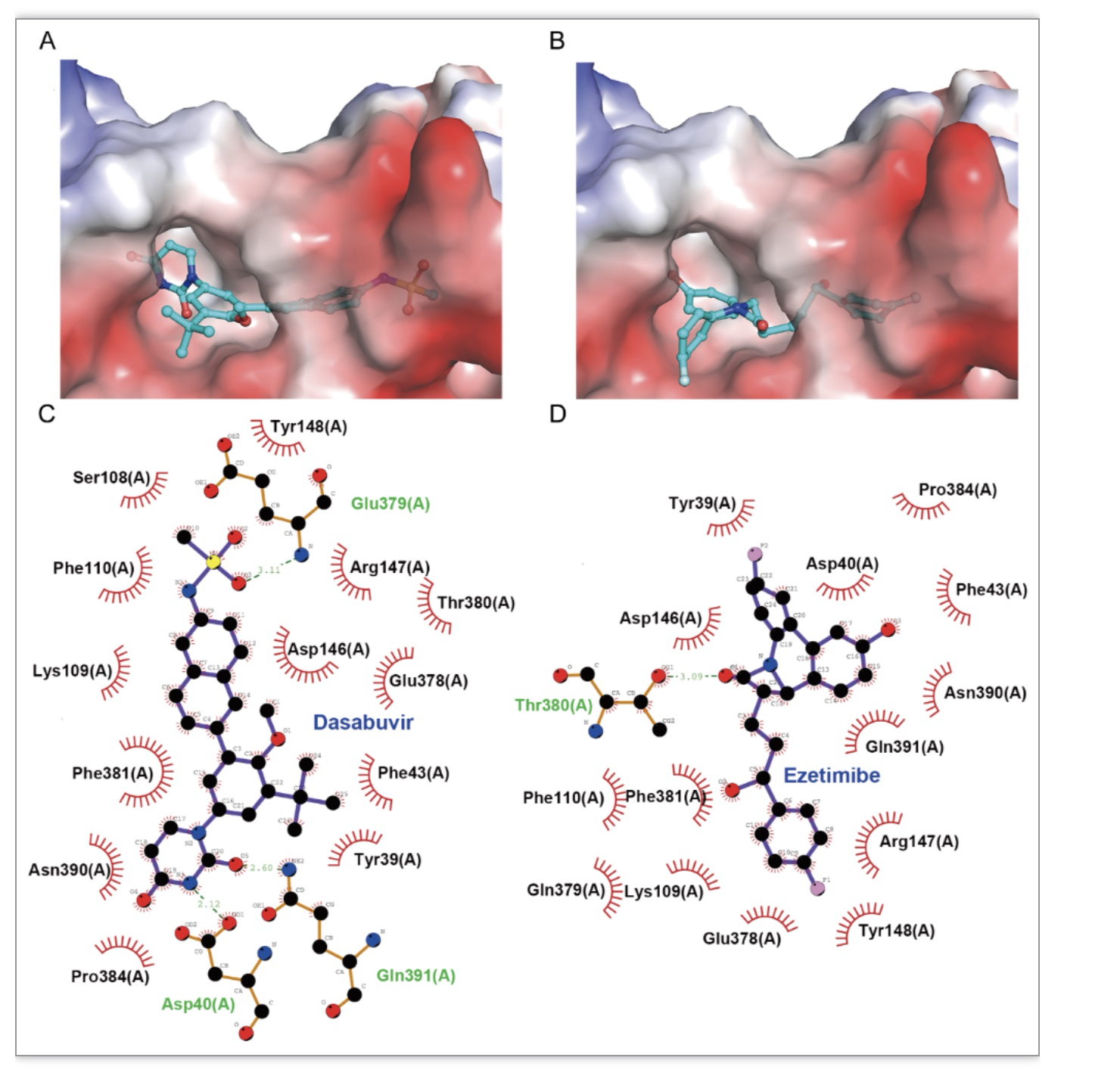
最后,研究人员利用iGEMDOCK进行分子对接锚定Dasabuvir和Ezetimibe在ROCK1的P3口袋处紧密结合。在LigPlot+中进行蛋白质-配体二维相互作用分析,发现ROCK1的16个氨基酸残基与Dasabuvir发生相互作用,其中3个形成氢键相互作用;而ROCK1的15个氨基酸残基与Ezetimibe发生相互作用,其中1个形成氢键相互作用(图6)。
图6 Dasabuvir和Ezetimibe与ROCK1的相互作用
本研究通过找寻ROCK1蛋白的非ATP结合位点,发现了一个在ROCK蛋白的特异性结合位点的变构结合口袋,称为P3口袋。经由该P3口袋结构,使用AutoDock Vina和iGEMDOCK的共识评分方法来虚拟筛选FDA批准的药物库中的抗病毒化合物。由体外病毒减少试验证明虚拟筛选中高评分的药物对EV-A71感染表现出不同程度的抗病毒作用。其中,Dasabuvir兼具良好的体外抗病毒活性和较高的虚拟筛选分数。同时,Dasabuvir在多种细胞系,如Huh-7、Caco-2、HT-29和HEK-293T中也显著抑制EV-A71的复制,且Dasabuvir的存在显著降低了EV-A71导致的促炎细胞因子MCP-1、TNF-α和RANTES的产生。值得注意的是,Dasabuvir抑制了CVA10的复制,但没有抑制CVB1的复制,这表明它可能是一种针对肠道病毒A类的有效广谱抗病毒药物。
研究存在一些局限性。Dasabuvir在体内是否具有类似的抗病毒活性还有待进一步阐明;虚拟筛选的实验测试候选药物数量不足;靶向宿主因子ROCK1可能导致毒性反应;需要通过分子动力学模拟和突变实验对筛选到的药物进行精确的结合位置评估。
综上,该研究进一步证实了ROCK1可能是一个潜在的药物靶点,并提示Dasabuvir可能是治疗EV-A71感染的临床候选药物,此成果将为虚拟筛选抗病毒药物的发现提供科学依据。