非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)由一系列肝脏代谢性疾病组成,其中,非酒精性脂肪性肝炎(nonalcoholic hepatitis,NASH)被认为是其最严重的亚型[1]。NASH的主要特点包括脂肪变性、炎症,伴或不伴有纤维化[2]。目前,NASH已成为肝移植的第二大常见原因,迫切需要有效的诊断和治疗干预[3]。然而,迄今为止,NASH的发病机制尚未完全阐明。“多重打击学说”认为NASH是遗传、肥胖、胰岛素抵抗、炎症级联反应等多重因素共同作用的结果[4]。
胆汁酸不仅能乳化肠道内的脂溶性分子并促进其吸收,也能调节肝脏中的脂质和葡萄糖代谢、炎症及纤维化[5]。越来越多的研究表明胆汁酸浓度和组成的改变与NASH的发生及其严重程度密切相关,胆汁酸衍生物或相关化合物有望成为NASH的治疗药物[6,7]。通过系统地收集最近的文献,我们总结了胆汁酸在脂质和葡萄糖代谢、肝脏炎症和纤维化中的作用及其相关信号通路,并揭示了胆汁酸在NASH治疗中的巨大潜力。
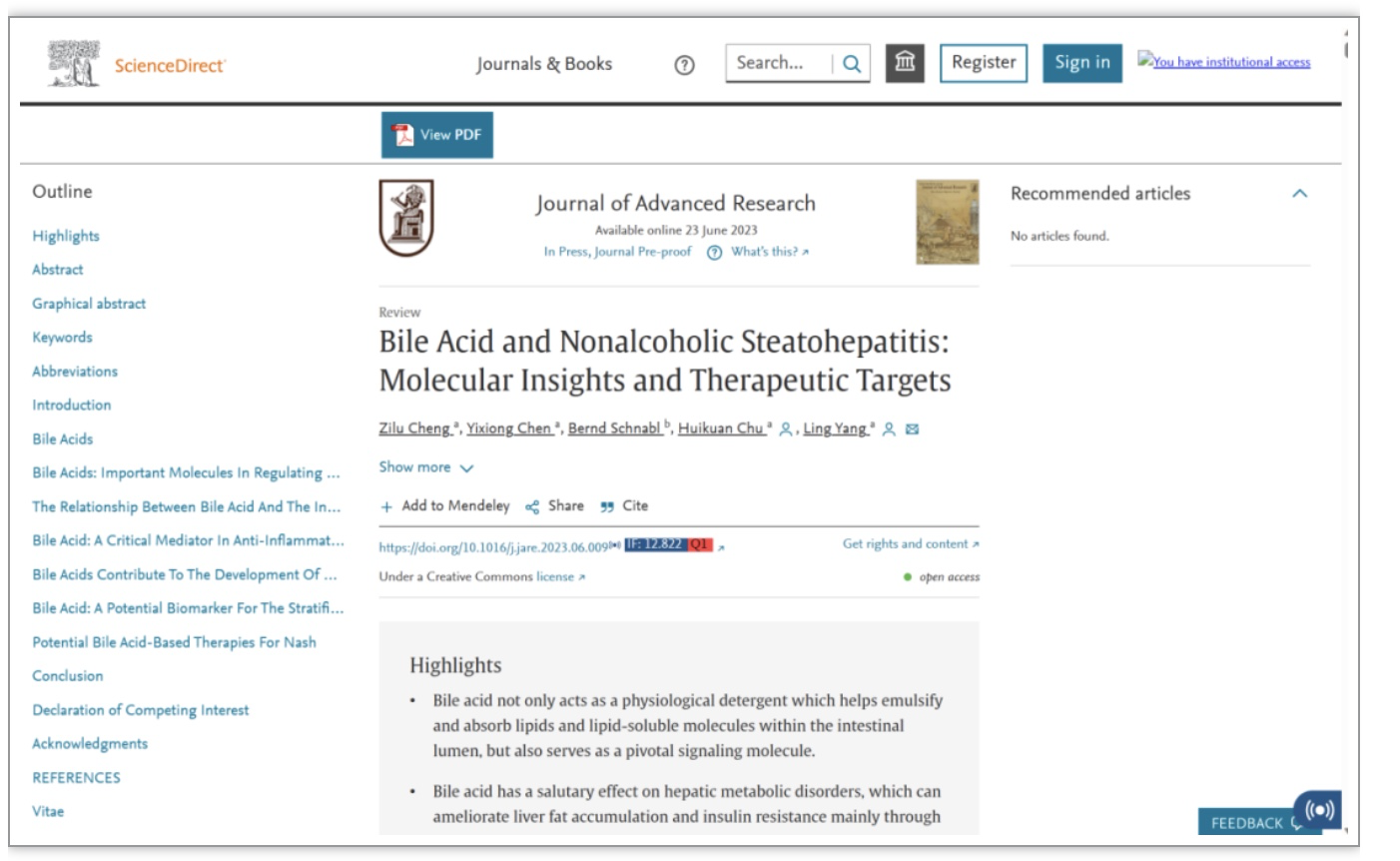
1. 胆汁酸的合成、转运和调节
肝细胞内的胆固醇可通过经典途径和替代途径合成初级胆汁酸,后者常与甘氨酸和牛磺酸结合,随后被分泌到胆管中[8]。在人体中,约有75%的胆汁酸通过经典途径合成,胆固醇7α羟化酶(cholesterol 7α-hydroxylase,CYP7A1)为这一途径的关键酶[9]。空腹时,胆汁酸大多进入胆囊并在此浓缩和储存。进食后,缩胆囊素分泌增加,胆囊收缩,Oddi括约肌松弛,储存在胆囊中的胆汁酸进入十二指肠[10]。当胆汁酸到达回肠末端时,此处的顶端钠依赖性胆汁盐转运蛋白介导95%的胆汁酸重吸收[11],此即为胆汁酸的肠肝循环(图1)。余下5%的胆汁酸进入大肠,在肠道细菌的作用下,转化为次级胆汁酸,一部分在大肠被被动吸收,一部分随粪便排出体外[12,13]。每日从粪便中排出的胆汁酸的量和在肝细胞中合成的量大致相等[14]。机体内的胆汁酸池在生理状态下保持动态平衡,这种平衡的维持是多种机制共同作用的结果。当胆汁酸的浓度升高时,肝细胞内的FXR被激活,后者可诱导小异二聚体伴侣抑制肝相关同源物1和肝细胞核因子4α[15,16]。这两种被抑制的核因子可进一步抑制CYP7A1基因的表达,从而减少胆汁酸的合成[14]。另外,胆汁酸含量的升高还可激活肠道中的FXR,进而增加成纤维细胞生长因子(fibroblast growth factor,FGF)15/19的产生,后者可与肝细胞上的FGF受体4(FGF receptor 4)/β-Klotho受体结合,进而抑制CYP7A1基因的表达[17,18]。FXR除了能调节胆汁酸的合成,还能调节胆汁酸的转运。激活的FXR既可诱导胆汁酸排泄受体的表达,又可抑制胆汁酸吸收受体的表达,因而可有效减轻胆汁酸的累积[19,20]。
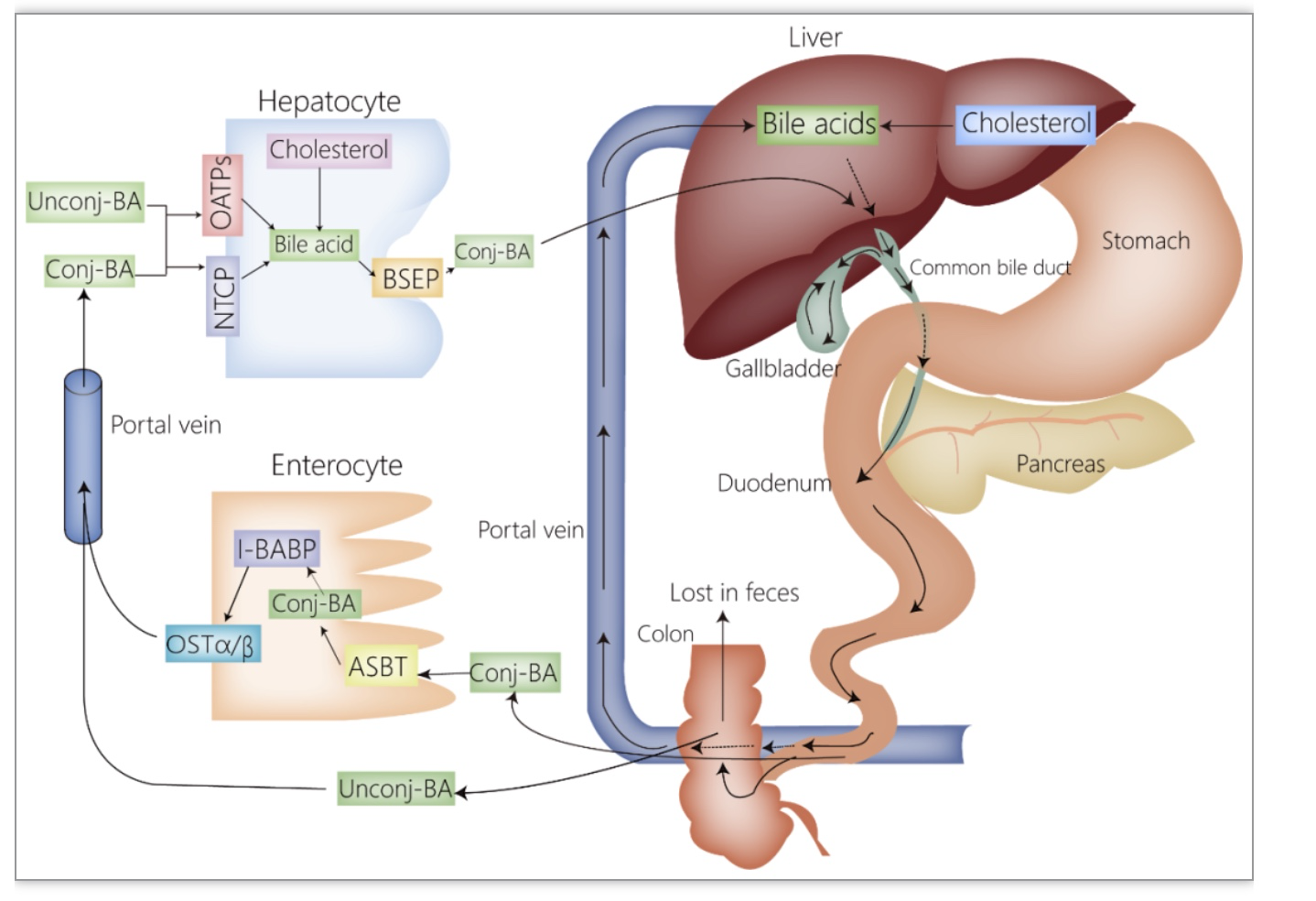
图1. 肠肝循环
2. 胆汁酸在糖脂代谢、肝脏炎症和纤维化中的作用
TGR5在介导胆汁酸对糖代谢的调节中发挥重要作用(图2)。分布在肠道L内分泌细胞上的TGR5被胆汁酸激活后,刺激胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)分泌[23,26]。GLP-1可促进胰岛素的分泌并改善胰岛素抵抗[26]。另外,分布在褐色脂肪组织的TGR5被胆汁酸激活后,可增加褐色脂肪组织的热量产生,这大大提高了葡萄糖的摄取和利用率[27,28]。除TGR5外,FXR也参与胆汁酸对糖代谢的调节(图2)。肝脏内活化的FXR使得糖原合成酶激酶3磷酸化抑制,从而导致糖原合酶的磷酸化水平降低,糖原合成酶活性升高,糖原合成增加[23]。肠道内活化的FXR促进FGF19的产生,后者作用于肝脏,使得环磷腺苷效应元件调节蛋白去磷酸化失活,抑制了糖异生相关基因的表达,糖异生减少[29]。值得注意的是,在另一项利用人和鼠来源的肝细胞、鼠来源的肝组织的研究中,FXR可诱导磷酸烯醇式丙酮酸羧激酶的表达,促进糖异生,使血糖升高[30]。这一与前相矛盾的结果可能与物种差异
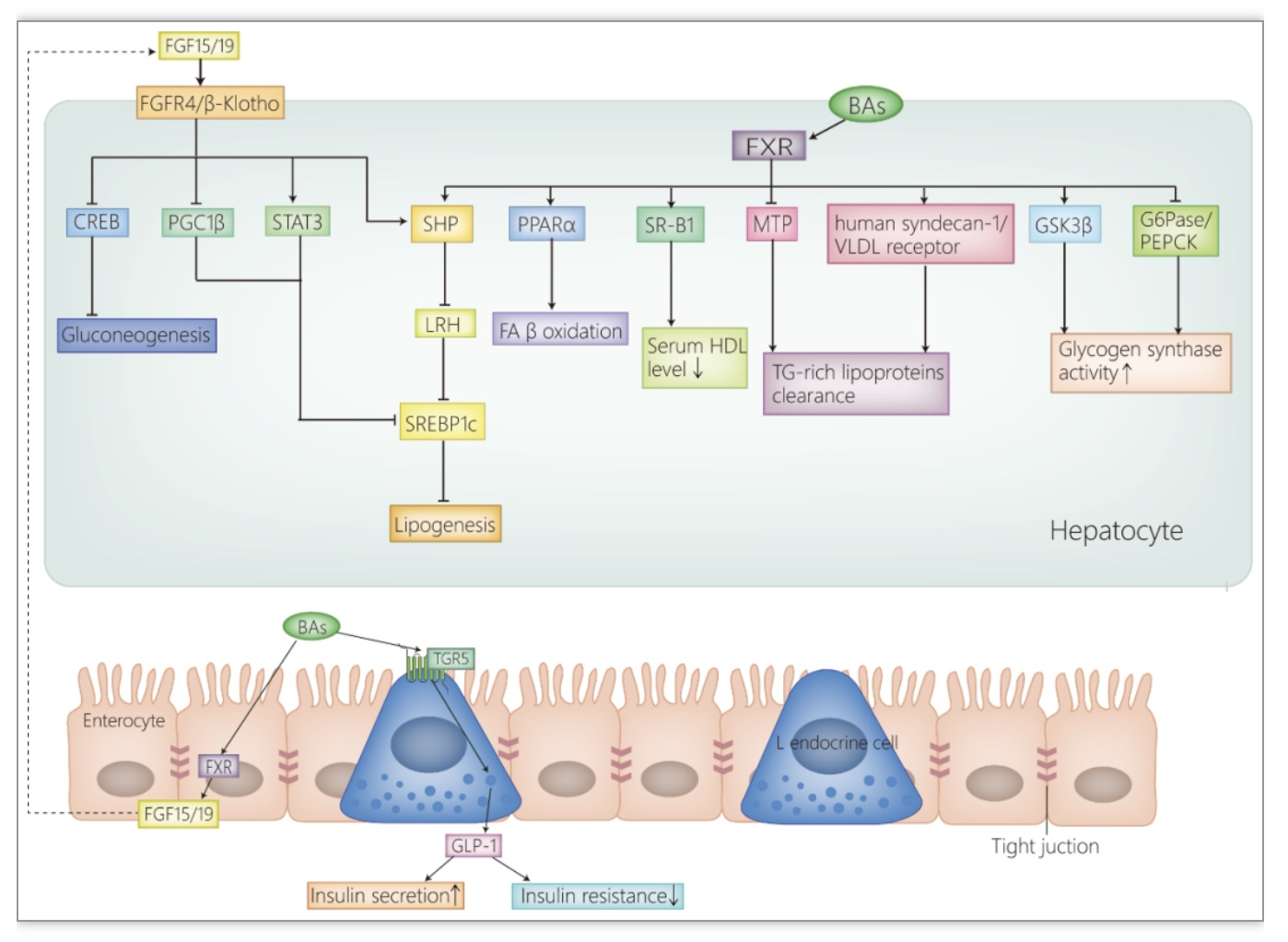
图2. 胆汁酸对糖脂代谢的调节
分布在免疫细胞的FXR和TGR5被胆汁酸激活后,发挥抗炎效应。活化的FXR可通过抑制核因子-kB(nuclear factor kappa B,NF-kB),抑制促炎基因的表达,减少炎性细胞因子的生成,还可通过直接作用于核苷酸结合寡聚化结构域样受体蛋白3(NOD-like receptor protein 3,NLRP3)炎症小体,下调炎性细胞因子,从而减轻炎症[31,32]。类似地,TGR5也可通过抑制NLRP3炎症小体来降低炎性细胞因子的表达[33]。除此之外,TGR5还可负性调节单核细胞趋化蛋白1,后者能调节单核/巨噬细胞的迁移和浸润[23]。分布在肝星状细胞(hepatic stellate cells,HSCs)中的FXR被胆汁酸激活后发挥抗纤维化效应。FXR能诱导抗纤维化基因如过氧化物酶体增殖物激活受体γ的表达,后者与HSCs的失活密切相关[34,35]。另外,FXR还可负向调节细胞外的胶原沉积,改善纤维化[23]。
综上所述,被胆汁酸激活的FXR和TGR5可改善脂质沉积、胰岛素抵抗、炎症和纤维化,从而抑制NASH的病理进展。然而,在某些研究中,胆汁酸却被认为可加速疾病的进程[36,37]。在由高脂高胆固醇饮食诱导的NASH大鼠模型中,胆酸处理可剂量依赖性地加重模型鼠的肝脏脂肪变性、炎症和纤维化[36]。处于病理浓度下的胆汁酸,被认为是强效的致炎因子,可刺激肝细胞分泌炎性细胞因子和趋化因子,加速单纯性脂肪变向NASH的病理进展[37]。
3.胆汁酸在NAFLD分级和NASH治疗中的巨大潜力
NASH是NAFLD最严重的亚型,可以进展为肝纤维化、肝硬化和肝癌[10]。在长期纵向研究中,肝纤维化是肝脏相关不良事件或死亡率最重要的预兆[38]。尽管肝脏病理活检可作为肝纤维化的金标准,但其是有创和较为昂贵的,并且会给病人带来身体上的不适[39]。因此,寻找有效的无创的肝纤维化早期诊断方法迫在眉睫。Caussy等[40]发现NAFLD患者的纤维化分期与空腹总胆汁酸水平相关。Nimer等[41]发现肝脏炎症程度较重的NAFLD患者往往有较高水平的共轭初级胆汁酸。Puri等[42]表明空腹总共轭胆酸水平升高的NAFLD患者,更容易进展为晚期肝纤维化(F≥2)和具有更高的NAFLD活动评分(NAS≥4)。这些研究表明分析胆汁酸谱可能是进行NAFLD分级的手段之一,当然,这还需要更深入的研究。
迄今为止,饮食控制和体育锻炼仍然是NAFLD早期的主要治疗手段[43]。当NAFLD进展为NASH后,单纯的生活方式的改变不足以有效地缓解疾病。然而,目前并没有获得批准的用于NASH治疗的药物[44]。鉴于胆汁酸能够调节糖脂代谢、抗炎和抗纤维化,许多动物性和临床性研究着眼于胆汁酸及其衍生物在NASH治疗中的作用。事实上,已有大量研究证实了胆汁酸及其衍生物在NASH中的治疗潜力(图3)。FXR激动剂,如奥贝胆酸、西洛菲索、托菲索等,已在动物实验和临床实验中被证实可以减轻NASH的脂肪变性、炎症和纤维化[45,48]。但其带来的不良作用,包括黄疸、低密度脂蛋白胆固醇的升高、高密度脂蛋白胆固醇的降低,限制了其在临床上的广泛使用[49]。TGR5激动剂,BAR501,可减轻NASH模型鼠的血管损伤[50]。FXR和TGR5双重激动剂,INT-767和BAR502可改善NASH小鼠的肝脏脂肪变和炎症[51,51]。胆汁酸螯合剂,司维拉姆,在动物实验中被证实能减轻肝脏脂肪变性、炎症和纤维化[53]。胆汁酸结合物,鹅去氧胆酸精氨酸乙酯缀合物和Aramchol,分别在动物实验和临床2期实验中被证实能减轻肝脏脂肪变性[54,55]。FGF19类似物,Aldafermin,可以减轻肝脏脂肪变性和纤维化,但它也常带来许多不良作用,如恶心、腹泻、腹痛、肝细胞增殖等[56,57]。ASBT抑制剂,SC-435和依洛昔布,均可减轻NASH模型鼠的病理损伤,其中,依洛昔布还可调节肠道菌群、恢复肠道屏障的完整性[58,59]。
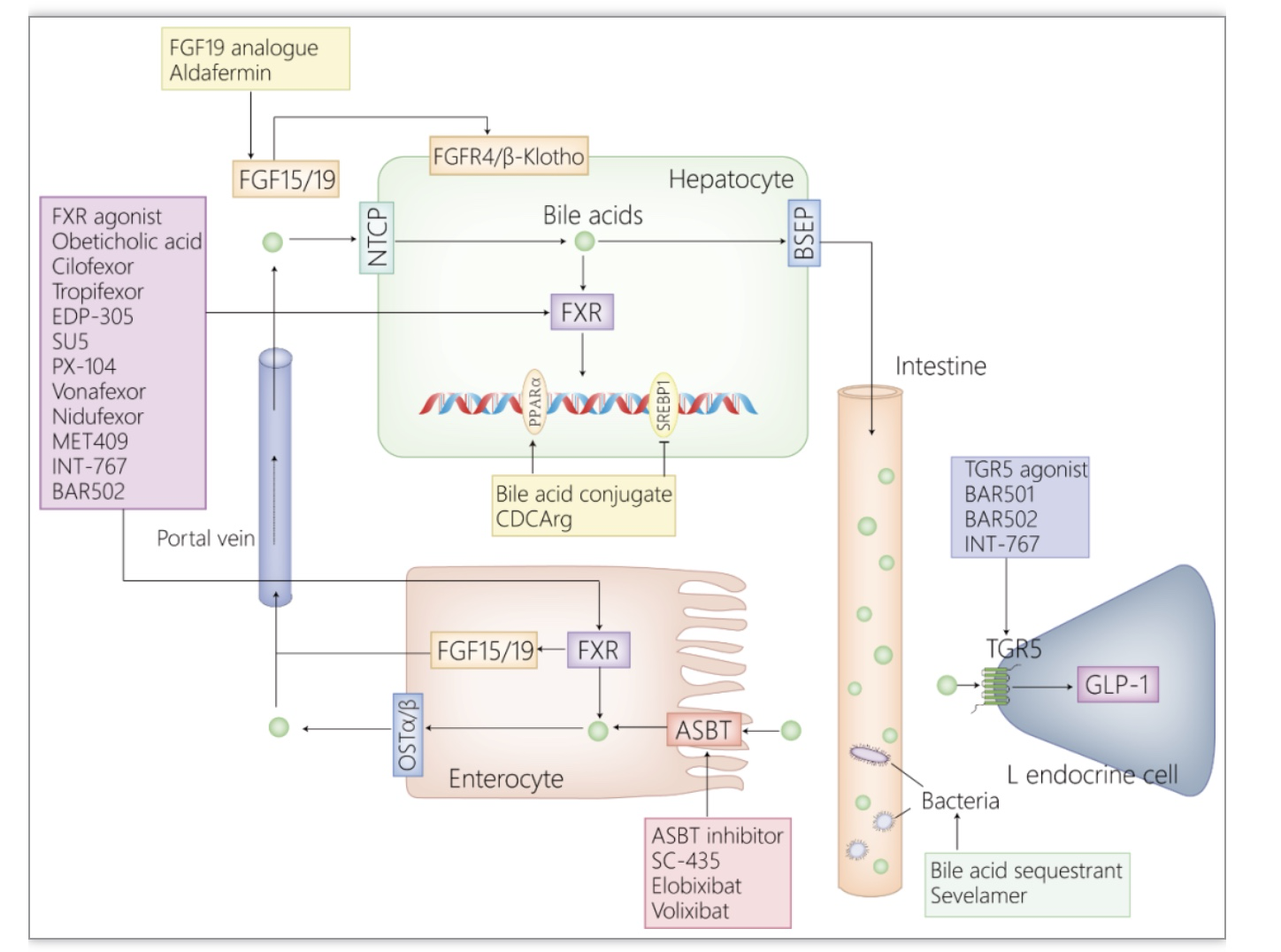
图3. 靶向胆汁酸的NASH治疗药物

