非酒精性脂肪肝(NAFLD)是影响全球数十亿人的最常见肝病。NAFLD在全球的患病率为25.24%,儿童群体脂肪肝发病率也由13%逐年上升至17%,值得注意的是9.8岁以下的患病儿童,内脏脂肪组织没有增加,这表明存在潜在遗传诱因。鉴于儿童期脂肪变性导致的非酒精性脂肪性肝炎(NASH)、肝脏疾病和恶性肿瘤的死亡率更高,早期预测和检测致病性NAFLD是公共卫生的首要挑战。在成年人中,对NAFLD/NASH的敏感性是高度可变的,并非所有肥胖的人都会出现脂肪变性,而且大多数脂肪变性病例不会发展为慢性肝病。因此,了解NAFLD/NASH易感人群对制定预防和治疗策略意义重大。
尽管学界对许多疾病的遗传基础的理解已经取得了进展,但目前仍只能解释一小部分常见疾病病因。当遗传多效性与代谢因素和疾病交叉时,会使致病性的遗传解释进一步复杂化。NAFLD的主要合并症是2型糖尿病(T2D),在美国,根据年龄组的不同,NAFLD和T2D的合并患病率在32%至90%之间。由于NAFLD和T2D通常存在于同一患者中,所以所识别出的基因突变是否针对单一疾病仍不清楚。
葡萄糖激酶调节蛋白(GCKR)rs1260326:C>T单碱基突变(SNP)是之前报道识别的突变之一。GCKR几乎只在肝细胞中表达,并被认为在葡萄糖利用和脂肪生成中发挥关键作用。葡萄糖激酶调节蛋白(GCKR)-rs1260326突变与NAFLD的关系存在广泛争议,这种突变似乎可以保护患者免受糖尿病和慢性肾脏疾病的影响,但与NAFLD和其他疾病的风险增加有关。因此,完全了解GCKR-rs1260326的多效性作用对于更深入的诊断和预后至关重要,尤其是对于NAFLD等高度异质性代谢疾病。
2022年10月13日,来自美国Cincinnati Children’s Hospital Medical Center的Takanori Takebe课题组在《Cell》杂志上发表题为《En masse organoid phenotyping informs metabolic-associated genetic susceptibility to NASH》的文章,就上述问题进行技术革新和细节探讨。
类器官是一种可以尽可能排除外在复杂因素并对基因型和表型进行研究的优良实验模型。近期,从诱导多能干细胞(iPSC)分化而成的代谢相关细胞类型研究,已经验证了一组人类基因表达变异信息,如基因表达定量性状位点(eQTL)。基于类器官技术发展成熟,类器官可以模仿在健康和疾病中活体器官的解剖和生理特征信息。
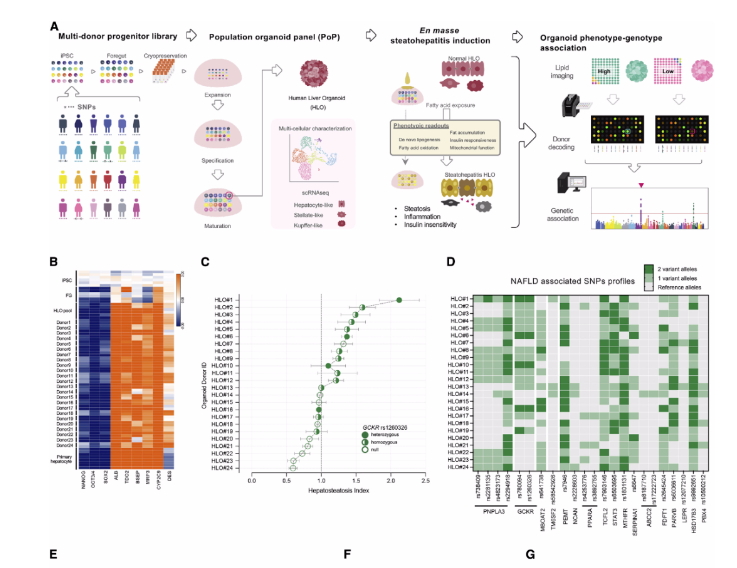
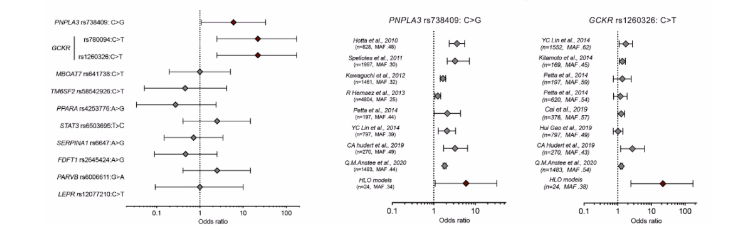
首先,为了评估NAFLD基因型-表型相关性,作者建立一个由24个不同基因型的供体iPSC系组成的HLO平台。为了加快和促进对24个供体HLO的比较分析,作者改进了iPSC分化方案,通过来自24个供体的冷冻保存的前肠祖细胞的混合群体建立了人类群体类器官平台(Population organoid Panel,PoP)。通过单细胞测序评估合并HLO的多细胞组成。与作者之前的实验结果一致,改进方案也能够平行产生肝细胞样、巨噬细胞样和星状细胞。为了在PoP-HLOs中产生NAFLD表型,作者用常见的脂肪酸油酸(OA)诱导,OA诱导的PoP模型成功复制了胰岛素不敏感的NASH样特征,伴随着糖代谢紊乱、脂肪生成增加、脂肪酸氧化受损和炎症加剧。接着作者试图利用活体BODIPY染色成像脂肪定量策略来确定基于类器官的基因型表型关联是否可以预测常见的NAFLD相关SNP基因型。每个供体携带多个SNP,作者通过比值分析显示HLO脂质积累表型与已报道存在风险SNPs的关联性,确定了一组非酒精性脂肪肝的核心遗传因子,包括GCKR rs1260326:C>T。(图1)
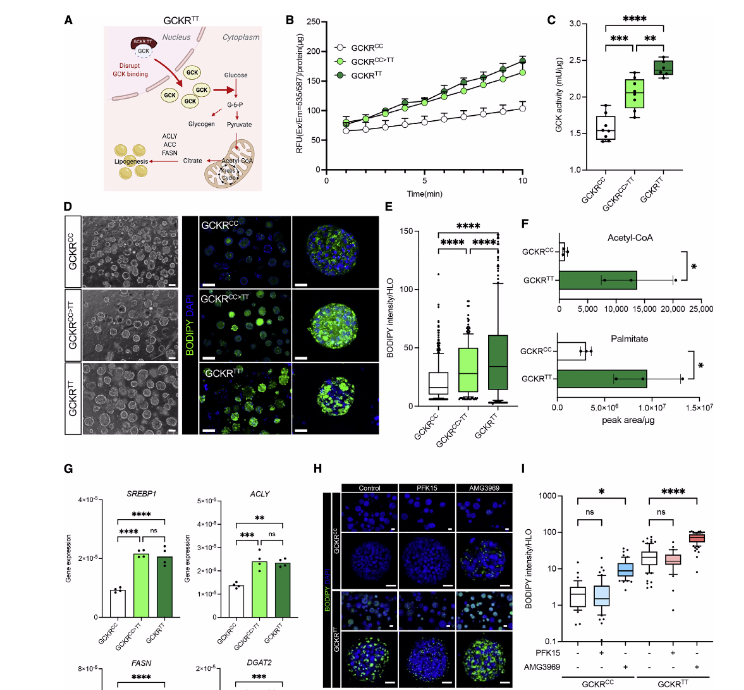
图1:脂肪性肝炎类器官平台解释已知基因型-表型与肝脂肪变性的相关性
在肝脏中,GCKR与葡萄糖竞争结合葡糖激酶(GCK),结合后使GCK失活,部分将GCK保留在细胞核中。GCKR-rs1260326 TT变体结合GCK的能力降低,激活肝脏葡萄糖摄取和糖酵解,随后过量乙酰辅酶a的产生,这是脂肪生成的限速底物。
为了评估HLO模型中GCKR-rs1260326 TT变体(GCKRTT)的发病机制,作者选择了三种iPSC系,分别为GCKRTT、GCKRCC、GCKRCC>TT(基因编辑),以此专门测试该SNP的致病影响。研究发现,GCKRTT和GCKRCC>TT HLOs中的GCK活性始终高于GCKRCCHLOs。接下来,作者评估了GCK高活性是否能促进新生脂肪生成(DNL)。在没有外源性脂肪酸负荷的标准高糖和高胰岛素培养条件下,第30天BODIPY成像分析显示,与GCKRCCHLOs相比,GCKRTT和GCKRCC>TT HLOs产生和积累的脂滴显著更多。因此,GCKR-rs1260326 TT变体可促进GCK酶的活性、脂滴的形成和不饱和长链脂肪酸的积累。(图2)
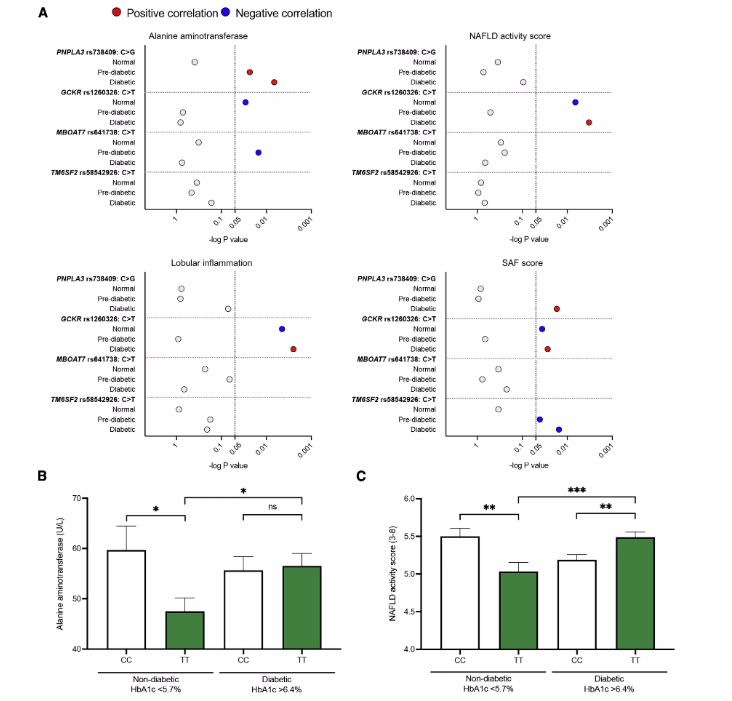

图2:GCKR-rs1260326 TT基因型对HLO中脂肪堆积的易感性的影响
作者发现,在sHLO模型和高度可变的临床报告之间,GCKRTT变体的代谢影响存在差异,即在评估GCKR-rs1260326等位基因的临床数据时,是否应该考虑其他共病代谢特征,如糖尿病症状。为了进行活体评估,作者对1091名被诊断为NASH的成年人队列进行了回顾性分析,队列中NAFLD临床参数和遗传风险变体之间的相关性分析集中在GCKR-rs1260326变体上。对NASH临床队列的分析显示,在携带GCKRTT变体的患者中,当糖化血红蛋白HbA1c值在正常<5.7%范围内时,NAFLD活性评分[NAS]、小叶炎症[LI]、脂肪变性活性和纤维化[SAF]评分明显优于参考GCKRCC。与此形成鲜明对比的是,当HbA1c值>6.4%即糖尿病的范围内时,GCKRTT的各项评分高于其他GCKRCC队列,即GCKR-rs1260326-T等位基因仅在糖尿病状态下可提高疾病的严重程度。值得注意的是,当将非糖尿病与糖尿病的亚组进行比较时,NAFLD/NASH炎症病理学的恶化在GCKRTT组中最为明显,而对于GCKRCC变体,糖尿病HbA1c>6.4%的情况不会恶化炎症病理,但有改善(较低)评分的趋势。因此,对于携带GCKRTT变体的患者,HbA1c测量可能对描述NAFLD相关炎症病理的严重程度具有预测价值。(图3)
图3:GCKR-rs1260326 TT基因型与HbA1c水平相关的炎症风险相反
为了评估GCKRTT对细胞的影响,作者对来自基因型患者肝细胞样本的RNA-seq数据集进行了无碱基转录组学分析。差异分析发现在GCKRTTNASH肝细胞中,与GCKRCTGCKRCC肝细胞相比,脂肪生成基因、炎症相关基因显著上调,这与比较GCKRCCandTT的OA诱导的sHLO模型显著一致。有趣的是,下调的基因包括线粒体ATP合成酶的多个亚基,于是作者试图验证其HLO模型中线粒体功能是否受到干扰。作者发现,与GCKRTT HLO相比,GCKRTT sHLO的耗氧率(OCR)显著降低。此外,与GCKRCC sHLO相比,在GCKRTT sHLO中ATP/AMP比率显著降低。与GCKRCC sHLO相比,这些结果与GCKRTT sHLO中通过活细胞染色定量的ROS增强一致。因此作者认为线粒体失调是GCKRTT变体细胞中ROS积累所导致的氧化应激增强的结果,脂肪酸积累加剧了氧化应激.
二甲双胍是用于治疗与肥胖相关的T2D的一种药物,然而与携带GCKRCCorCT的患者相比,携带GCKRTT的患者在二甲双胍治疗48周后,多项T2D指标没有改善。作者为了验证HLO模型是否反映了这些活体观察结果,评估了二甲双胍治疗sHLO的效果,并评估了控制GCKRTT sHLO中ROS升高是否可以更好地调节过量脂肪酸积累的不良影响。
在控制不必要的ROS生成的机制中,作者专注于解耦氧化磷酸化过程,具体而言,GCKRTT sHLO补充了NAD+前体烟酰胺核糖(NR)和硝唑嗪(NTZ),最近被证明能增强线粒体功能。作者首先证明了NR和NTZ在GCKRTT HLO系统中的作用,NR和NTZ联合处理逆转了GCKRTT sHLO组OCR水平,恢复能量消耗,是由于NR和NTZin的协同作用增加了NAD+的可用性,同时DNL和脂肪酸诱导的炎症基因表达受到抑制。相反,二甲双胍治疗在实际上增加了ROS,这可能会加剧疾病表型。总的来说,GCKRTT变体和脂肪酸暴露引起的线粒体功能障碍的易感性可以通过氧化性解偶联来减轻,该解偶联允许适度增加的脂肪酸供应,同时提供抗氧化应激保护。
非酒精性脂肪肝(NAFLD)是影响全球数十亿人的最常见肝病。NAFLD在全球的患病率为25.24%,儿童群体脂肪肝发病率也由13%逐年上升至17%,值得注意的是9.8岁以下的患病儿童,内脏脂肪组织没有增加,这表明存在潜在遗传诱因。鉴于儿童期脂肪变性导致的非酒精性脂肪性肝炎(NASH)、肝脏疾病和恶性肿瘤的死亡率更高,早期预测和检测致病性NAFLD是公共卫生的首要挑战。在成年人中,对NAFLD/NASH的敏感性是高度可变的,并非所有肥胖的人都会出现脂肪变性,而且大多数脂肪变性病例不会发展为慢性肝病。因此,了解NAFLD/NASH易感人群对制定预防和治疗策略意义重大。

