慢病毒是以HIV-1发展起来的一种病毒载体。在数十年的应用中,慢病毒也不断地优化了其生物安全性和有效性,目前已经成为体内外生物实验中一种功能非常强大的基因传递工具。在基因传递方面,慢病毒拥有其诸多独特的优势:稳定持久表达、可感染多种类型细胞、可携带大片段基因、免疫原性比较低及不易诱发宿主免疫反应等。无论是基础科研还是临床研究,慢病毒载体都具有非常广泛的应用前景。今天,小编为大家总结了近些年来慢病毒的应用热点。
RNA干扰研究
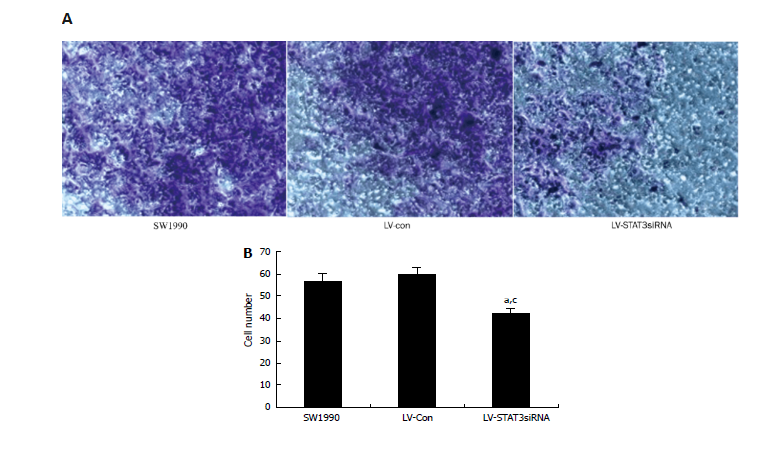
研究人员采用慢病毒介导的RNA干扰系统,研究STAT3(信号转导及转录激活蛋白3)信号通路对胰腺癌细胞侵袭的影响。靶向STAT3的干扰慢病毒,侵染SW1990细胞后,成功的实现了STAT3基因沉默,而STAT3表达的下降,也导致了与肿瘤侵袭和转移相关的MMP-2和VEGF蛋白的表达量下降,最终降低了胰腺癌细胞的侵袭能力。这一研究表明STAT3是胰腺癌治疗的一个潜在的靶点[2]。
A
Invasionassay was performed using a specialized invasion chamber(YangG et al,World J Gastroenterol,2009)
CRlSPR/Cas9 gRNA文库筛选
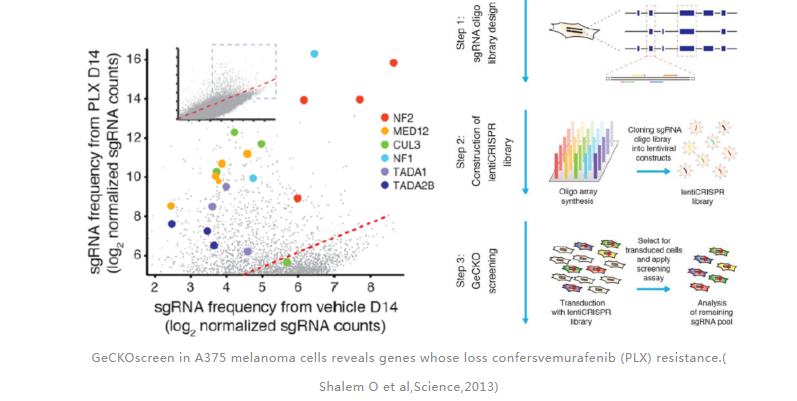
有研究报道,使用慢病毒载体将靶向18080个基因的sgRNA文库导入人黑色素瘤细胞A375,通过肿瘤抑制剂PLX药筛富集,最终筛选出与肿瘤细胞耐药性相关的NF1、MED12、NF2、CUL3、TADA2B和TADA1六个基因[3]。
GeCKOscreen in A375 melanoma cells reveals genes whose loss confersvemurafenib (PLX) resistance.( Shalem O et al,Science,2013)
稳转细胞株构建
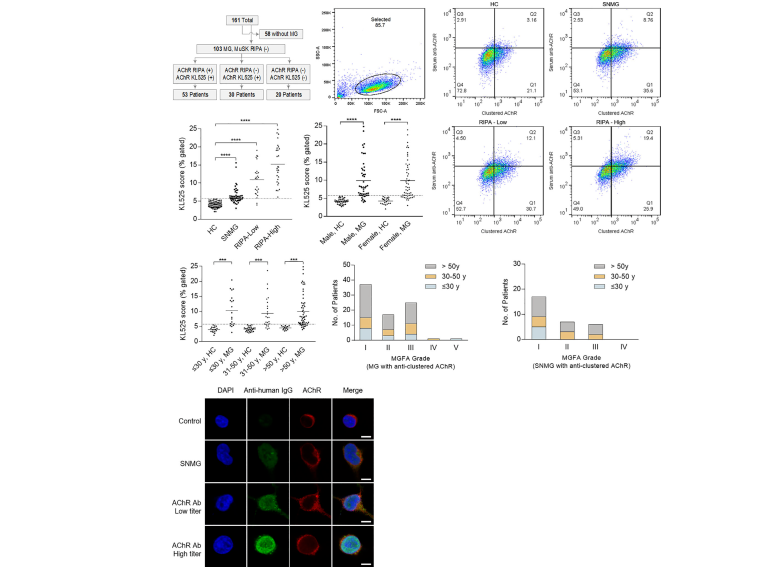
重症肌无力患者目前最灵敏的检测方法是使用CBAs或RIPA检测AChR抗体。目前临床应用上检测方法是采用AChR相关蛋白表达质粒瞬转HEK293细胞后进行检测。而这种方法耗时,成本高且批次间稳定性差。研究人员为了优化这一检测技术,采用慢病毒转染HEK293细胞构建了KL525细胞系,使其稳定过表达AChR蛋白亚基和其聚集蛋白rapsyn。经检测发现,该细胞系蛋白表达水平在15代以内没有差异,且在CBA检测中表现出更高的灵敏度[4]。
Detectionof AChR in patients with myasthenia gravis.( Cai Y et al ,FrontImmunol,2021)
转基因动物
另有研究利用雄性生殖细胞成功制备了转基因小鼠。他们使用慢病毒将GFP荧光基因转导入小鼠精子细胞。然后将载有外源基因的小鼠精子通过体外受精,形成受精卵,再通过胚胎移植导入母鼠体内。结果显示,产生的42%的幼鼠携带GFP基因,对小鼠不同组织进行切片检测,GFP荧光基因可以稳定的遗传到第三代转基因小鼠。这一实验也说明了,采用慢病毒介导的基因传递是一种十分高效且稳定的转基因方法[5]。
GFPexpression from transgenic F0 mice and F3 generation.(ChandrashekranA et al, FASEBJ.2014)
活体细胞成像追踪技术
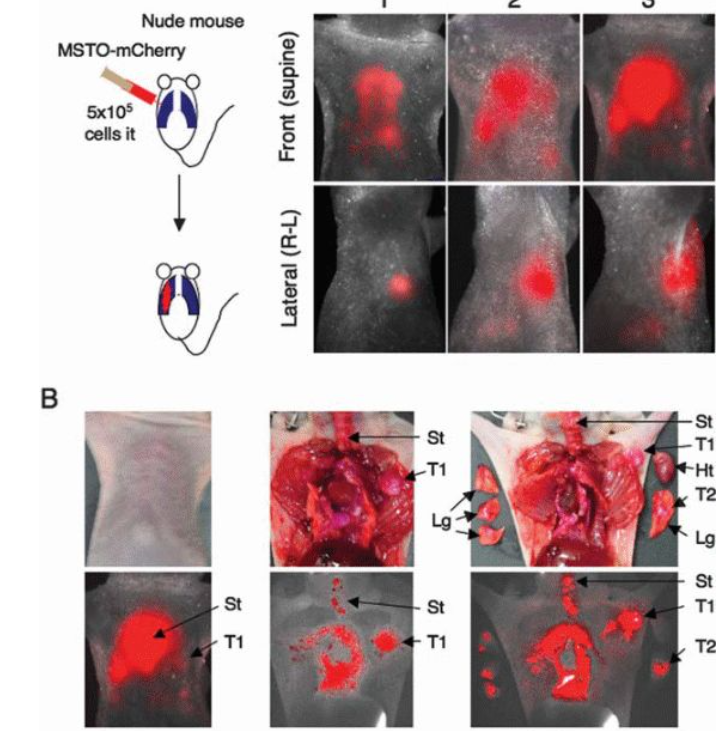
恶性间皮瘤,是一种预后比较差且高度侵袭性的肿瘤,急需新的治疗方式的出现。而在肿瘤治疗研发中,开发一种可以进行荧光成像的恶性间皮瘤动物模型,用于新药效果测试追踪是十分必要的。研究人员使用慢病毒将mcherry荧光基因导入该肿瘤细胞,然后将培养的细胞注射到小鼠体内,成功的建立了可以进行荧光成像追踪的人恶性间皮瘤的成像小鼠模型。通过荧光成像技术,监测mcherry荧光,可以追踪肿瘤细胞在小鼠体内的传播和微转移,可用于肿瘤的药物治疗效果追踪[6]。

Whole-bodyfluorescence imaging in an intraperitoneal mesotheliomaxenotransplant model.(Yamaoka N et al, IntJ Oncol.2010)
神经系统科学
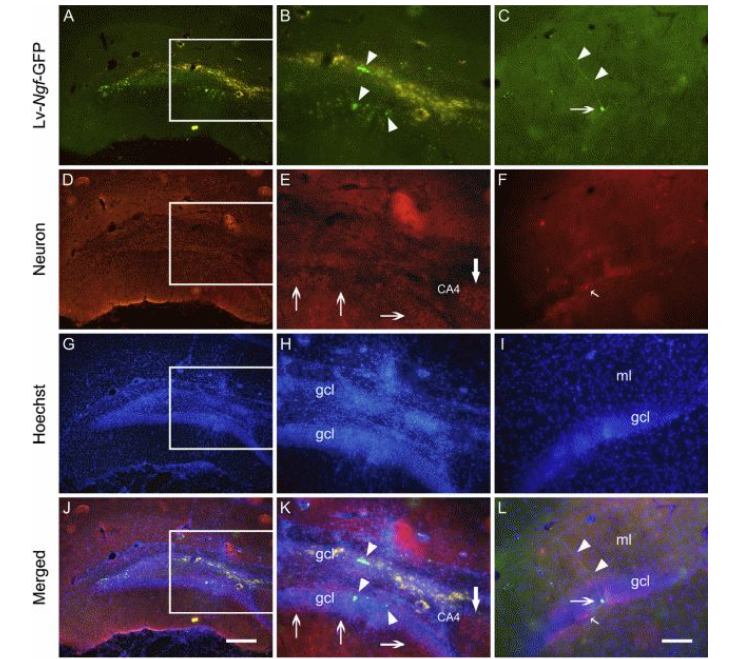
创伤性脑损伤的治疗,周期漫长、费用较高且效果不是很好。而神经生长因子(NGF)和脑源性神经营养因子(BDNF)是具有修复神经系统损伤的功能的。LinY等研究人员制备携带NGF-GFP融合基因的慢病毒载体,将其直接注射到脑损伤大鼠的海马部位。转导的融合基因蛋白持续表达了四周以上,且NGF的表达可诱导神经元样细胞突触生长,且保护细胞免受氧化损伤,这些结果表明慢病毒介导的NGF转导能够挽救大鼠脑损伤[7]。

Locationof the pseudo lentivirus-delivered b-Ngf fusion gene expression afterits injection in the injured brain(LinY, et al. Biomaterials.2015)