免疫检查点疗法作为一种备受关注的肿瘤治疗方法,通过共抑制或共刺激信号等一系列途径以调节T细胞活性来杀伤肿瘤细胞[1-3]。然而,一些肿瘤对目前广泛应用的免疫检查点抑制剂表现出耐药性,从而限制其在临床中的应用。因此,寻找新的药物靶点以提高癌症治疗效果迫在眉睫。α2-肾上腺素能受体能够通过Gi信号传递途径抑制腺苷酸环化酶的功能,从而减少环磷酸腺苷(cAMP)和蛋白激酶A (PKA)的激活[4-6]。而在肿瘤微环境中,也存在通过激活腺苷酸环化酶来增加cAMP的水平以发挥免疫抑制功能的机制,从而抑制抗肿瘤免疫反应。因此作者推测激活α2-AR可能通过抑制腺苷酸环化酶,阻断多个增加cAMP水平的免疫抑制途径从而发挥抗肿瘤免疫作用。

为了探究α2-AR在肿瘤进展中的作用,作者分别使用三种不同的α2-AR激动剂和两种拮抗剂处理结肠癌小鼠模型,发现α2-AR激动剂guanabenz (GBZ)、clonidine (CLD)和guanfacine (GFC)可有效抑制肿瘤生长,而α2-AR拮抗剂yohimbine (YHB)和phentolamine (PHE)不影响肿瘤生长。作者继而在11种不同肿瘤小鼠模型中也得到了相同结论,并且α2-AR激动剂对免疫检查阻断疗法无效的难治性肿瘤,如肺癌TC-1,黑色素瘤B16F1、原发性黑色素瘤TiRP模型等展现良好疗效。考虑到α2-AR激动剂的抑癌效果与肿瘤细胞表达的α2-AR水平并无关系,且α2-AR激动剂在NOD/Scid/Il-2rg−/−(NSG)免疫缺陷小鼠不能发挥作用,作者推测α2-AR激动剂的抑癌作用是免疫系统介导的。α2-AR激动剂具有良好疗效小鼠的肿瘤中浸润更多的CD8+ T淋巴细胞,且Rag1敲除(缺乏功能性T和B淋巴细胞)背景下,GBZ对TiRP小鼠没有作用,表明淋巴细胞介导α2-AR激动剂的抑癌作用。作者给NSG小鼠分别皮下注射人卵巢癌SK-OV-3、人结直肠癌LS411N和人前列腺癌PC-3 细胞,待肿瘤形成后静脉注射人PBMC,并使用GBZ或CLD治疗小鼠。实验发现三种肿瘤模型中α2-AR激动剂都具有明显抗肿瘤作用且肿瘤中浸润人CD8+T淋巴细胞显著增多,但没有人PBMC存在时α2-AR激动剂无效,表明α2-AR激动剂也可以促进人淋巴细胞对肿瘤的抑制。用α2-AR激动剂治疗的MC38-OVA、TC-1和TiRP肿瘤模型小鼠中肿瘤浸润淋巴细胞 (TIL)表面的PD-1水平和肿瘤微环境中总细胞的 PD-L表达水平增加,作者进而使用α2-AR激动剂与免疫检查点阻断疗法组合治疗肿瘤,发现单独抗PD-1治疗有效的MC38-OVA 、CT26和B16F1 模型中,使用抗PD-1与α2-AR激动剂的组合显示出更显著的抗肿瘤作用,而在对抗 PD-1疗法无反应的TC-1模型中,组合疗法也部分改善抗肿瘤作用。对抗CTLA-4联合抗 PD-无效的TiRP肿瘤模型中,联合免疫检查点疗法的加入进一步提高GBZ的抗肿瘤作用。
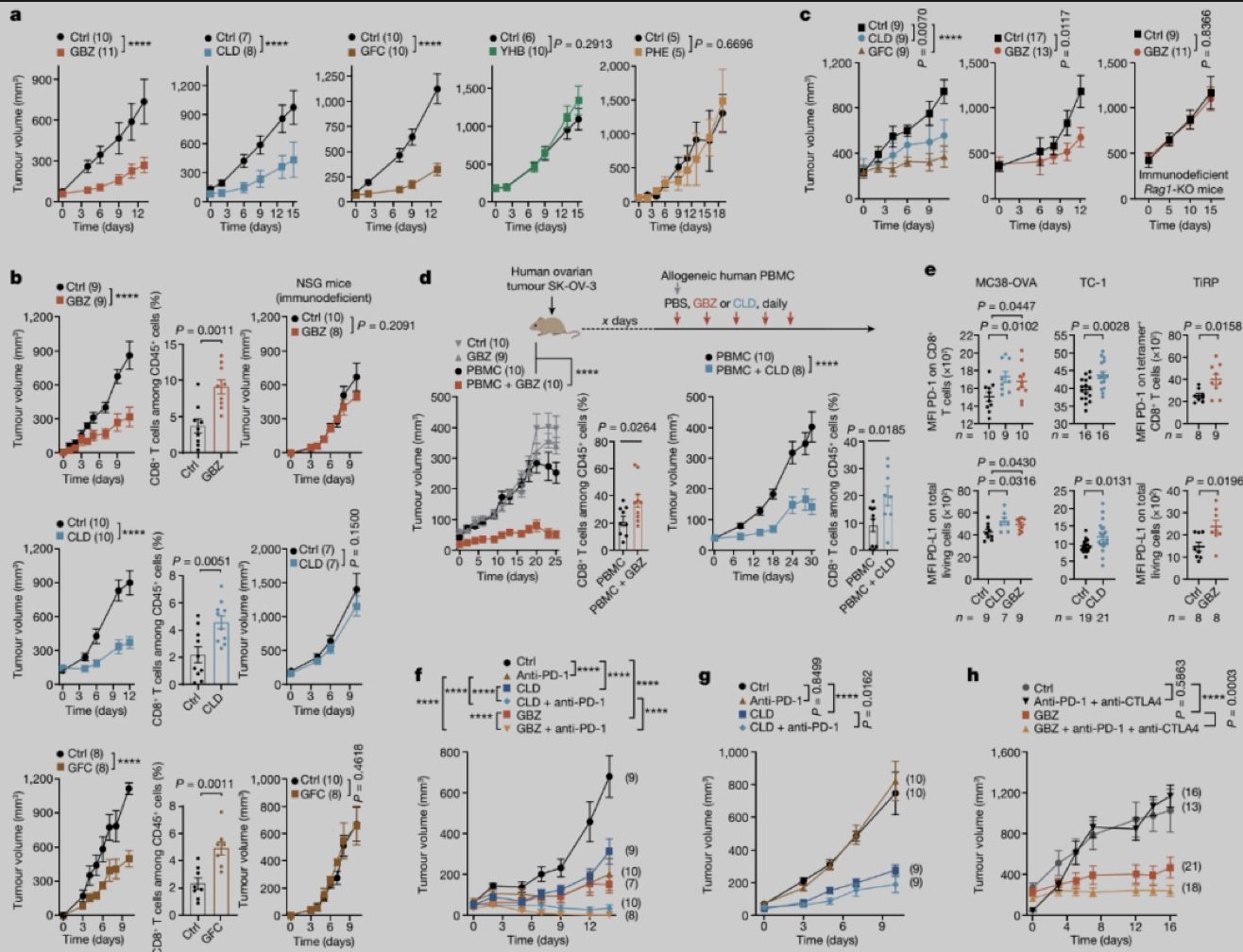
图1. α2-AR激动剂抑制多种肿瘤生长
α2a-AR是小鼠肿瘤中表达最高的α2-AR亚型,作者发现CLD和GBZ对MC38、MC38-OVA、TC-1和B16F10-OVA肿瘤的抑制作用在Adra2a-KO小鼠(敲除α2a-AR)中被消除,CD8+T 细胞的浸润也没有明显增加。在携带MC38-OVA 肿瘤的Adra2a -KO小鼠中联合抗PD-1治疗时,CLD和GBZ联合治疗作用失效,并且CLD对Adra2a -KO TC-1肺癌仍具有很好的抑制作用,表明α2a-AR是其激动剂介导抗肿瘤作用的实际靶点,α2-AR激动剂的抗肿瘤作用与对肿瘤细胞的直接作用无关,而是依赖于宿主免疫系统。
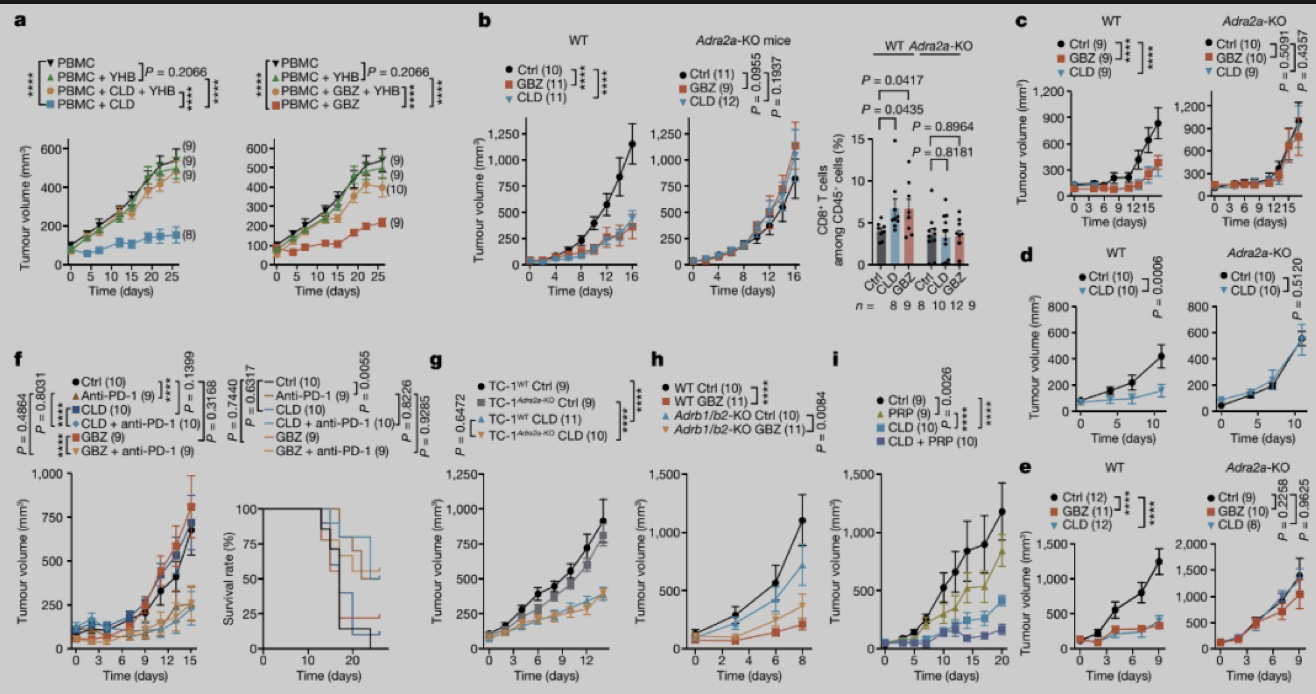
图2. α2-AR激动剂的抗肿瘤作依赖于宿主免疫系统
既然α2-AR激动剂的抑癌作用是免疫介导性的,作者推测可能是通过影响肿瘤微环境中的免疫细胞发挥作用。作者重点关注对抗PD-1疗法有部分作用的MC38-OVA 模型以及 免疫检查点疗法无效的TC-1模型。考虑到肿瘤模型中观察到CD8+ TIL浸润增加,作者首先检测α2-AR激动剂是否直接作用于CD8+ T淋巴细胞,发现α2-AR激动剂不影响CD8+T细胞的增殖和激活,但是清除掉CD8+T细胞后,CLD抑癌作用明显受损,表明CLD的抗肿瘤作用需要CD8+T细胞。作者进一步将WT OVA特异性OT-I CD8+T淋巴细胞过继回输到携带MC38-OV肿瘤的Adra2a-KO小鼠和WT小鼠,发现CLD对Adra2a-KO小鼠抑癌作用消失,而在WT小鼠中CLD具有明显抑癌作用,表明CD8+T细胞不是α2-AR激动剂的直接靶标。α2-AR激动剂除了增加CD8+T细胞浸润外,肿瘤浸润淋巴细胞(TIL)中CD8+T细胞活性增加,凋亡减少。并且CLD治疗后TC-1肿瘤小鼠的肿瘤、淋巴结和脾脏中CD4+T细胞浸润增加。作者也分析了α2-AR激动剂对骨髓源性抑制细胞(PMN-MDSCs)的影响,发现α2-AR激动剂减少TiRP小鼠肿瘤微环境中PMN-MDSC的数量,使MDSC不易诱导CD8+T细胞等TILs的凋亡,促进α2-AR激动剂协同CD8+ T细胞过继回输具有良好抗肿瘤作用。
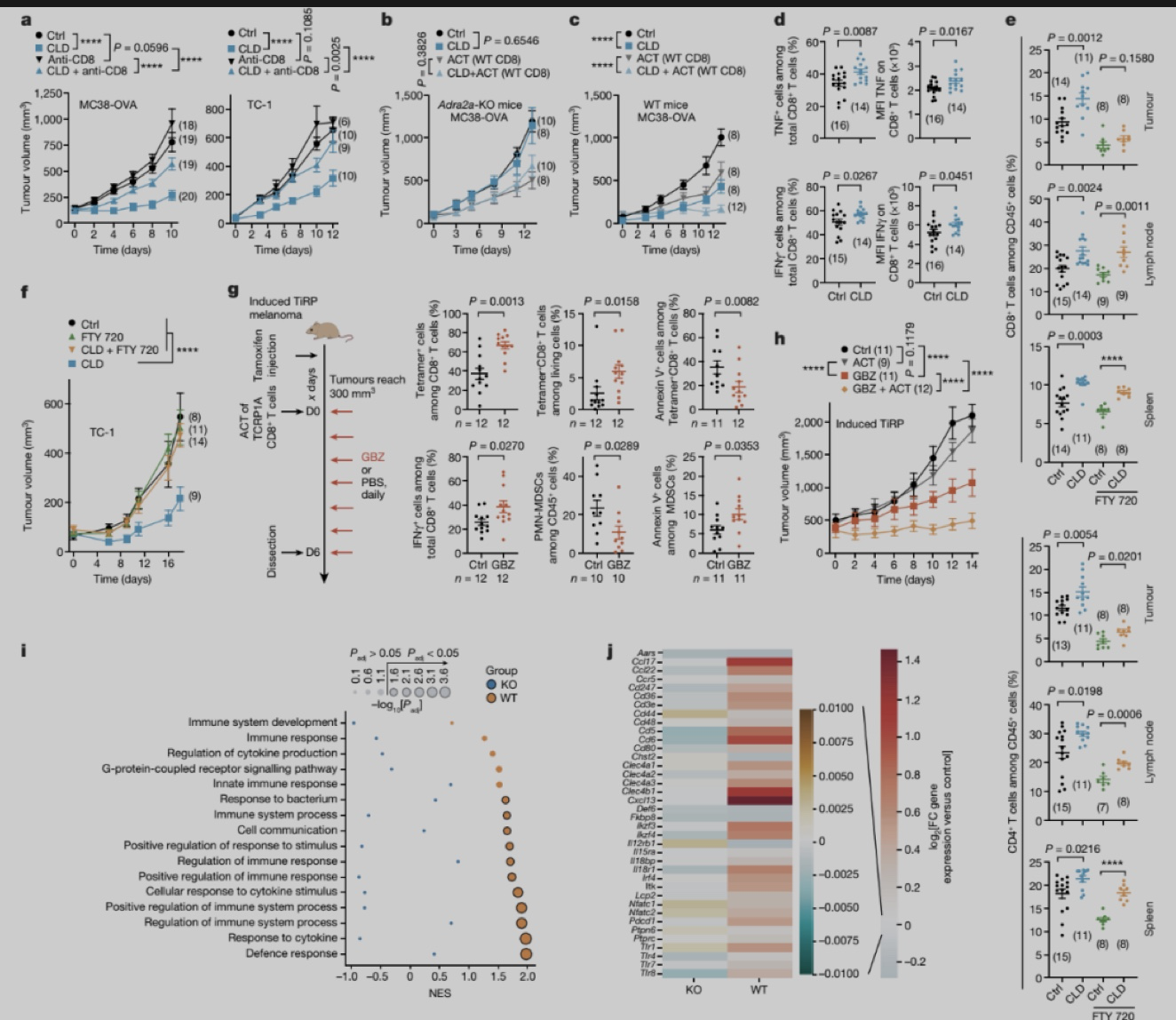
图3. α2-AR激动剂对CD8+T细胞和MDSCs的影响
为了研究α2-AR激动剂的作用机制,作者对来自 WT和Adra2a -KO小鼠的CLD治疗和未治疗的MC38-OVA肿瘤进行转录组分析,GSEA富集分析显示WT小鼠相比Adra2a -KO小鼠,经α2-AR激动剂处理后,固有免疫和适应性免疫激活相关的基因表达明显升高。单细胞转录组分析显示肿瘤微环境中最丰富的细胞群为巨噬细胞,包括5个亚群。CLD治疗后巨噬细胞亚群3几乎完全消失,被亚群1所取代。这两个巨噬细胞亚群的基因表达模式相似,但亚群1表现出 M1样巨噬细胞特征,高表达MHC-II类基因和促炎基因(Ccl2、Ccl3、Cxcl2和Ccl4),参与吞噬作用和抗原呈递,而亚群3表达较低水平的MHC-II 类相关基因以及Adgre1 (编码F4/80)和Itgam (编码CD11b)。CLD治疗诱导巨噬细胞亚群3到亚群1的转变表明能够吞噬和呈递抗原的活化巨噬细胞比例增加。GSEA 通路分析也表明,CLD 治疗增加了巨噬细胞的整体功能,增强了抗原加工/交叉呈递和内质网-吞噬体通路。使用 CellPhoneDB受体-配体数据库分析发现CLD治疗后巨噬细胞和CD8+ T细胞之间的相互作用的显著增加。作者通过流式分析也发现CLD治疗后,巨噬细胞浸润增加,MHC II表面表达更高,吞噬能力增强,而来自Adra2a -KO小鼠的肿瘤中巨噬细胞未观察到这些变化,提示巨噬细胞可能是α2-AR激动剂抗肿瘤作用的靶标。为了验证巨噬细胞的作用,作者使用氯膦酸盐脂质体清除MC38-OVA荷瘤小鼠的巨噬细胞,发现CLD的抗肿瘤作用减弱且TIL浸润没有增加。将WT巨噬细胞过继回输到Adra2a -KO小鼠中, CLD抗肿瘤作用和TIL浸润恢复, 表明巨噬细胞参与α2-AR激动剂的抗肿瘤作用。实验还显示,α2-AR激动剂激活巨噬细胞后,要想诱导有效的抗肿瘤免疫应答,CD4+/CD8+T细胞缺一不可。
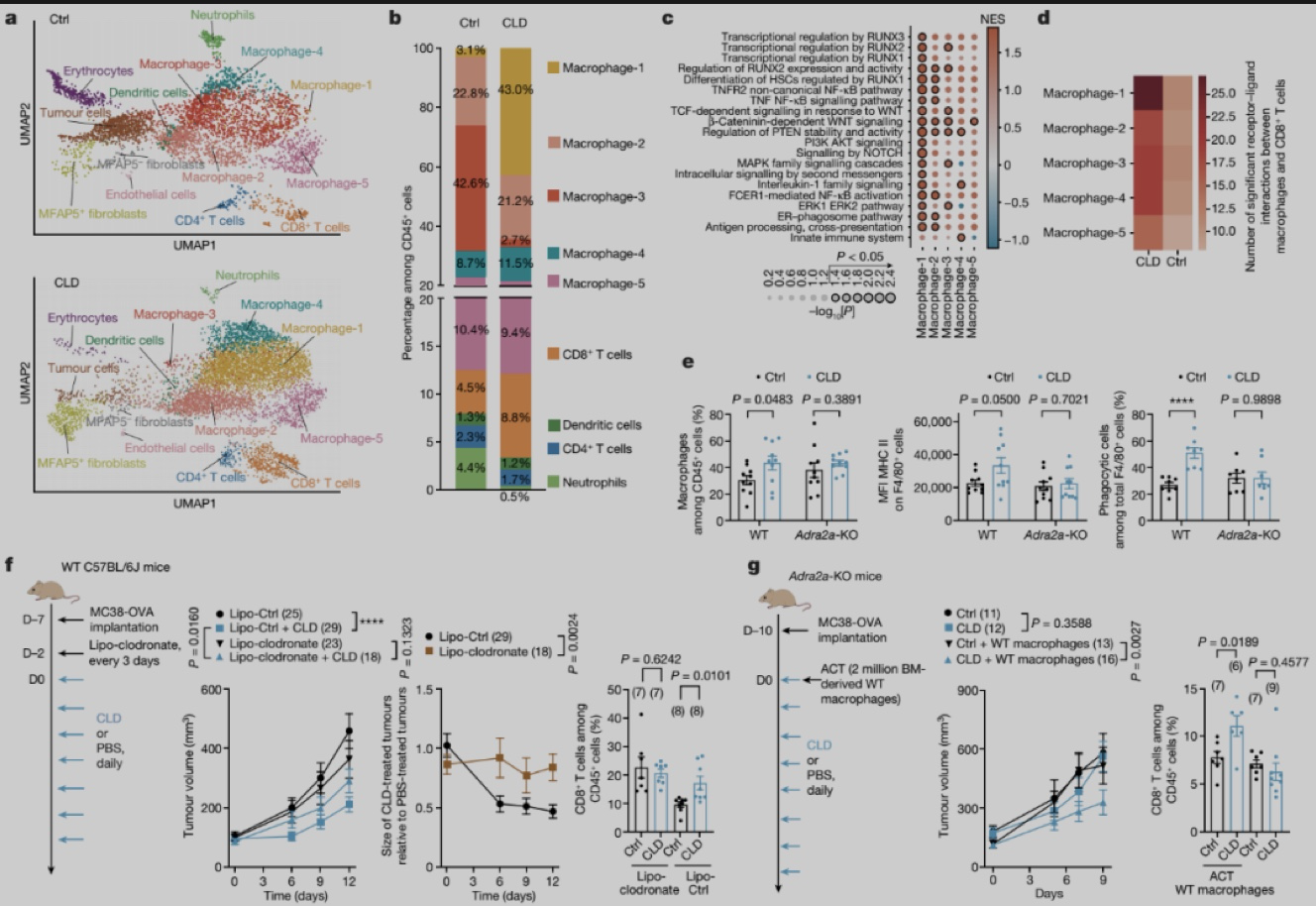
图4. 巨噬细胞在α2-AR激动剂抗肿瘤效应中的关键作用
分析TCGA数据发现,α2-AR的高表达与临床肺腺癌患者更好的总生存期之间存在显着关联,α2-AR激活相关的基因高表达,与PD-1抑制剂治疗黑色素瘤效果更好有关,表明α2-AR信号传导诱导促进免疫疗法的转录组学改变,提示α2-AR激动剂可能存在一定的临床转化应用潜能。
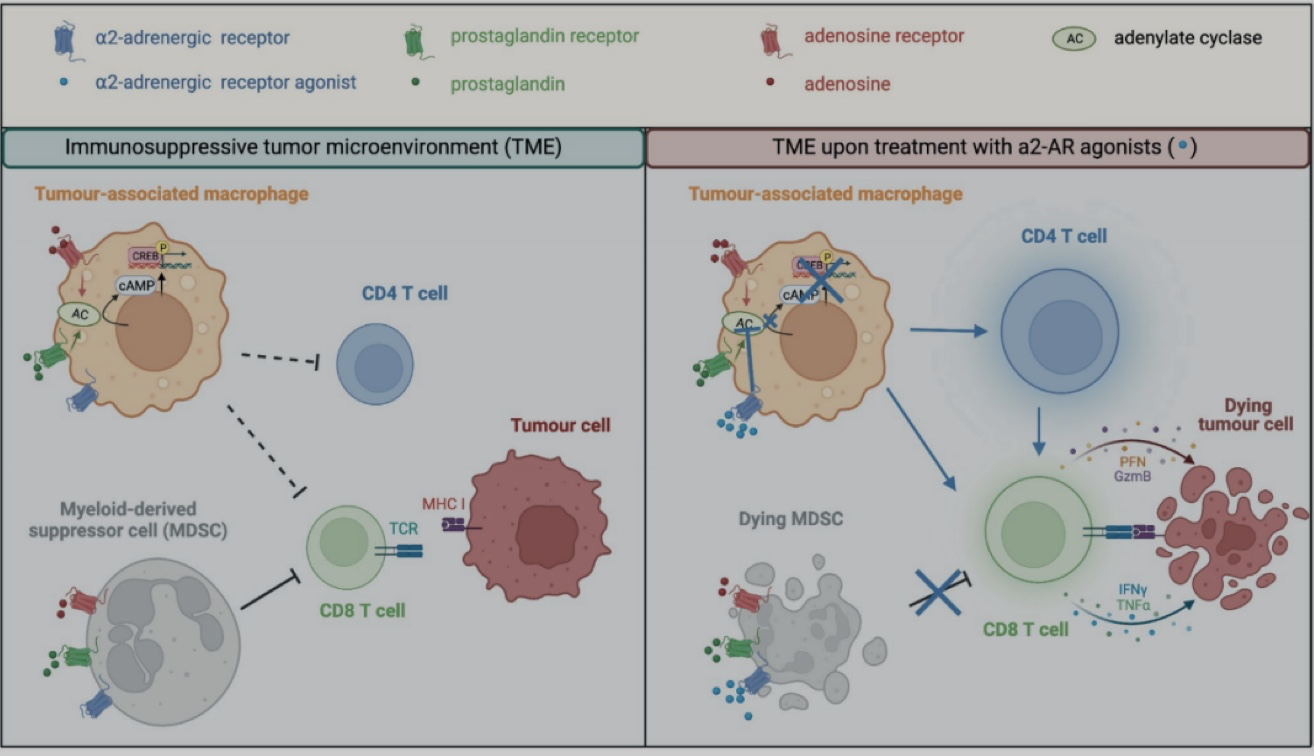
综上所述,作者表明α2-AR激动剂多种肿瘤模型中具有良好效果,强调α2-AR激动剂通过直接激活巨噬细胞以更好地在肿瘤微环境中募集和激活CD4+和CD8+T淋巴细胞发挥抗肿瘤作用,为开发新的免疫治疗策略和药物提供了全新的思路。但是除了MDSC和巨噬细胞外,α2-AR激动剂是否作用于有助于其抗肿瘤作用的其他细胞类型并不清楚,α2-AR激动剂具体作用于哪些关键信号通路,还需要进一步阐明。

