Th2细胞极化是过敏性气道炎症发生的关键病理过程,树突状细胞(DC)对于Th2细胞极化的启动和维持至关重要[1]。表达T细胞免疫球蛋白结构域分子-4(TIM4)的DCs能够将抗原信息传递给CD4+T细胞,启动CD4+T细胞与B细胞接触,诱导浆细胞产生抗原特异性IgE,从而引发相关的免疫反应。TIM4主要由DCs产生,在过敏反应的启动中起着关键作用[2-4],然而调控TIM4在DCs上表达的因素尚不明确。X-盒结合蛋白1(XBP1)作为一种位于内质网的转录因子及内质网应激的传感器,能够调节DC的活性[5],其参与的内质网应激也可破坏DC的稳态,然而XBP1是否在DC中调节TIM4的活性以促进过敏反应的发生尚不清楚。在此背景下,研究者提出假设:DC中的XBP1-TIM4轴可能参与了过敏性气道炎症中Th2细胞极化反应。

1. TIM4在气道DC上的表达需要XBP1
为了验证XBP1与TIM4是否存在正向调控关系,研究者使用重组尘螨变应原蛋白(Derf1)与环境污染物PM2.5分别刺激DC特异性XBP1敲除小鼠(Xbp1ΔDC mice)与XBP1条件性敲除小鼠(Xbp1f/fCd11c-Cremice)发现,Xbp1f/f组小鼠的气道TIM4+ DC数量明显高于Xbp1ΔDC组小鼠。同时,作者还检测了两组小鼠中气道DC的TIM4 mRNA及蛋白表达量,发现Xbp1f/f组小鼠显著高于Xbp1ΔDC组。因此得出结论,TIM4在气道DC上的表达依赖于XBP1。

图1 TIM4在气道DC上的表达需要XBP1
2. TIM4在DC上表达需要经由IL-2-XBP1通路的信号传导
由于在既往的研究中发现XBP1的表达可以被IL-15、IL-12和IL-2诱导,且XBP1对于DC的活性具有调节作用,研究人员评估了这些细胞因子对DC中XBP1表达的调节作用。发现,在培养液中添加IL-2可显著增加小鼠骨髓源性DCs (BMDCs)中的XBP1 mRNA和蛋白的丰度,而使用IL-15或IL-12孵育仅能少量增加XBP1 mRNA和蛋白的丰度。同时, IL-2刺激下的BMDCs中的XBP1和TIM4 mRNA丰度呈浓度依赖性增加。为了进一步明确在体内IL-2是否具有同样的功能,研究者使用IL-2对naïve小鼠进行滴鼻,发现从气道组织分离的DC中的XBP1和TIM4的表达呈剂量依赖的方式增加。另外,使用Derf1与PM2.5滴鼻发现PM2.5组和Derf1+ PM2.5组中气道DCs的IL-2、XBP1和TIM4的mRNA水平明显增高。因此认为IL-2-XBP1通路可以上调TIM4在DCs上表达。
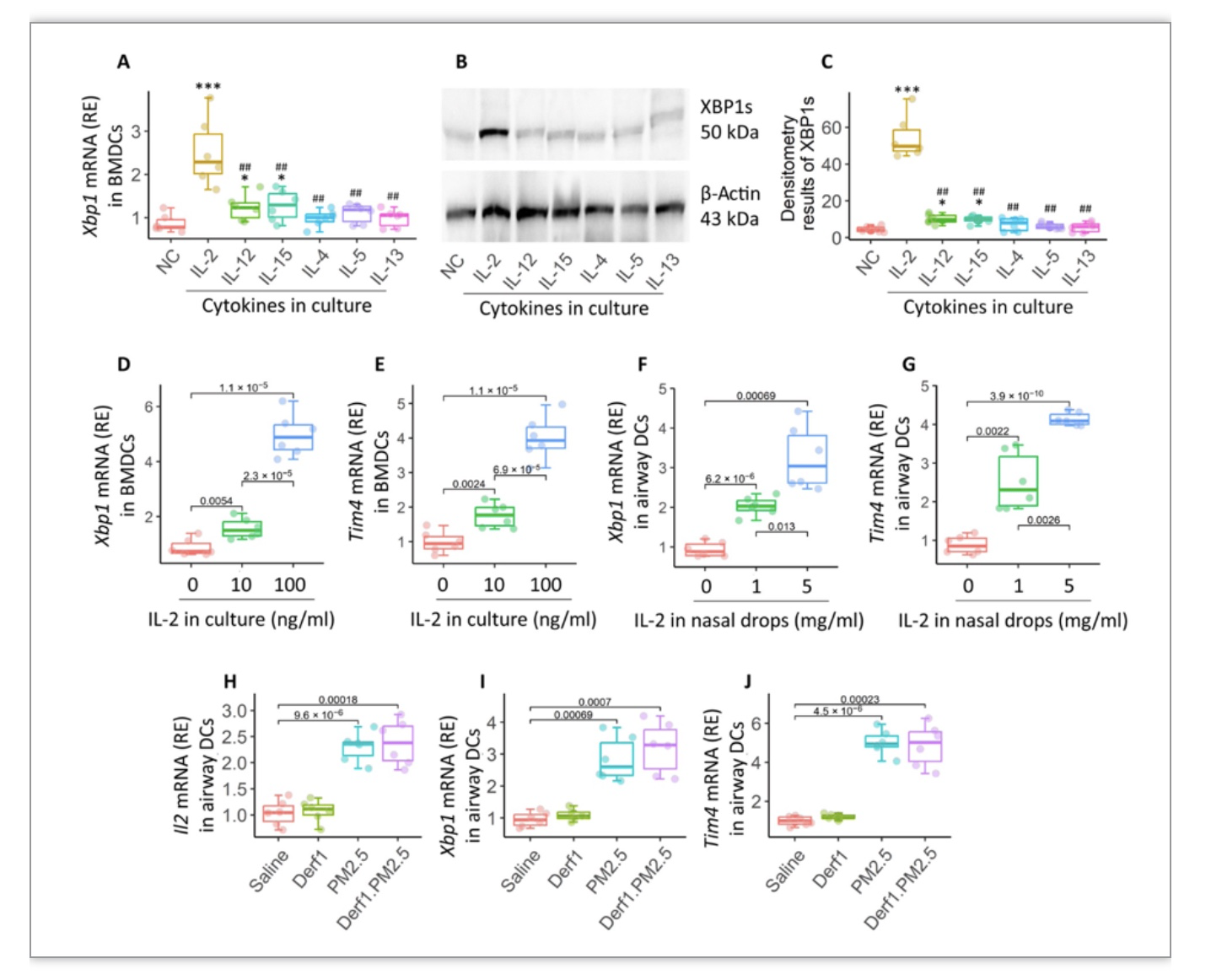
图2 TIM4在DC上表达需要经由IL-2-XBP1通路的信号传导
3. XBP1-TIM4轴参与了Derf1/ PM2.5诱导的Th2细胞应答
为了明确XBP1-TIM4轴是否参与了Derf1/ PM2.5诱导Th2细胞极化,研究者分别使用Derf1、PM2.5、Derf1/ PM2.5对naïve、Il2rbΔDC、Xbp1ΔDC、Tim4ΔDC四组小鼠滴鼻,发现在Derf1/ PM2.5共刺激下的naïve组小鼠肺泡灌洗液中的IL-4、IL-5、IL-13、EPX及MCPT1较其他组显著增高,血清IgE也显著上调,且该组的小鼠气道组织中CD4+T细胞和Derf1特异性Th2细胞的百分比均显著增加。结果显示,Derf1/ PM2.5经由XBP1-TIM4轴诱导的Th2细胞极化。
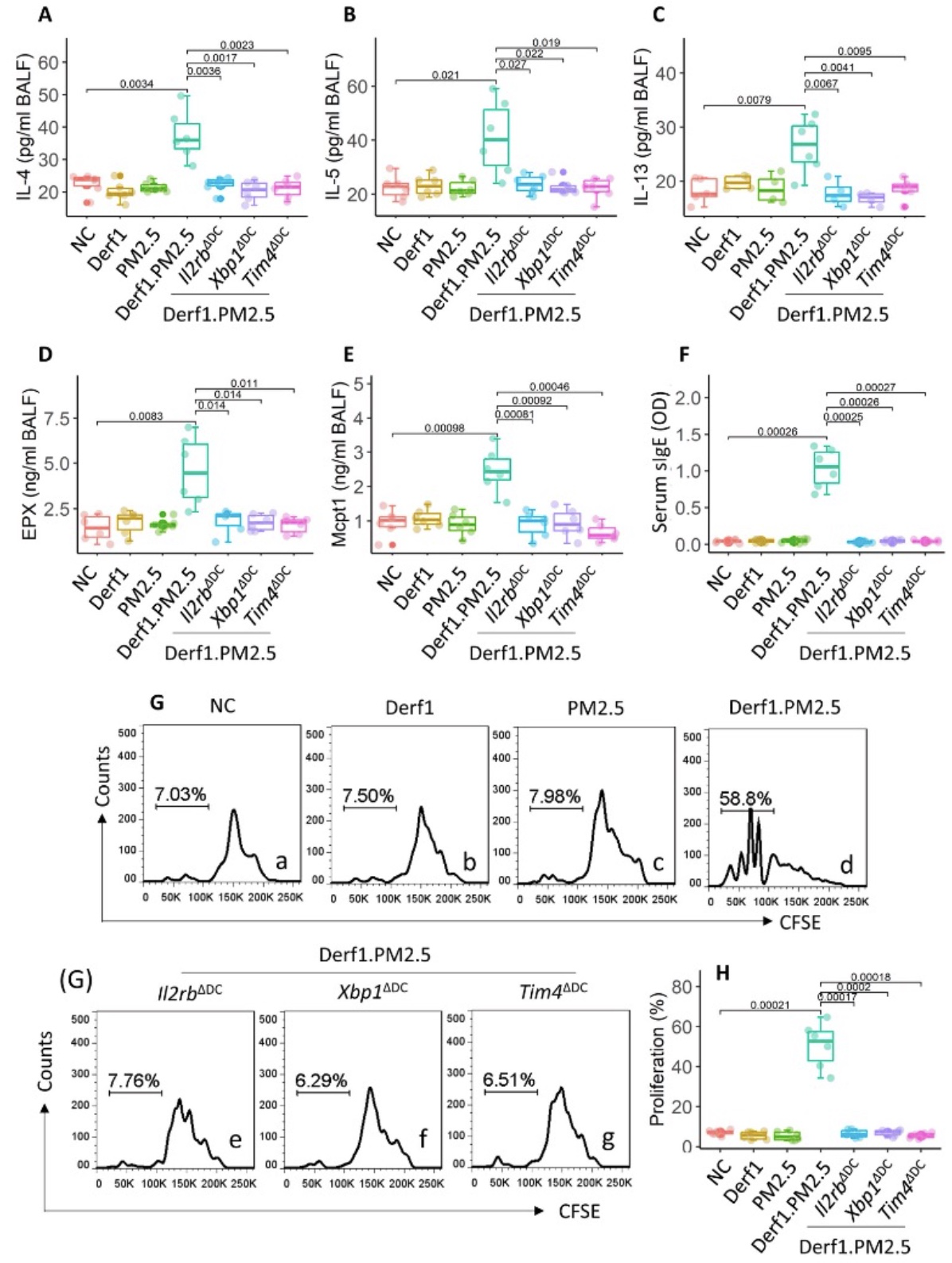
图3 XBP1-TIM4轴参与了Derf1/ PM2.5诱导的Th2细胞应答
4. XBP1在诱导DC中TIM4的表达中起关键作用
接下来,作者评估了XBP1对于DC中TIM4表达的作用。使用IL-2培养BMDCs 48小时后收获细胞,并将核蛋白提取物进行染色质免疫沉淀(ChIP)测定,发现XBP1蛋白和TIM4启动子在BMDCs中共定位。然而在表达His-Xbp1的质粒转染人胚胎肾(HEK) 293细胞的核提取物中ChIP分析并没有发现His-Xbp1和TIM4启动子之间的结合,由此推断可能有一个额外的因子介导XBP1和TIM4启动子之间的结合。随后提取核蛋白并用抗XBP1抗体沉淀并使用质谱(MS)分析免疫沉淀产物,检测出SOS1可能介导XBP1和TIM4启动子之间的结合。为了验证这一结果,使用His-Xbp1及Flag-SOS1质粒转染HEK293细胞,在免疫沉淀产物中检测到His-XBP1和Flag-SOS1复合物,该复合物也能够与TIM4启动子结合,并导致TIM4的表达上调。因此,XBP1对于DC中TIM4的表达具有直接正向调控作用。
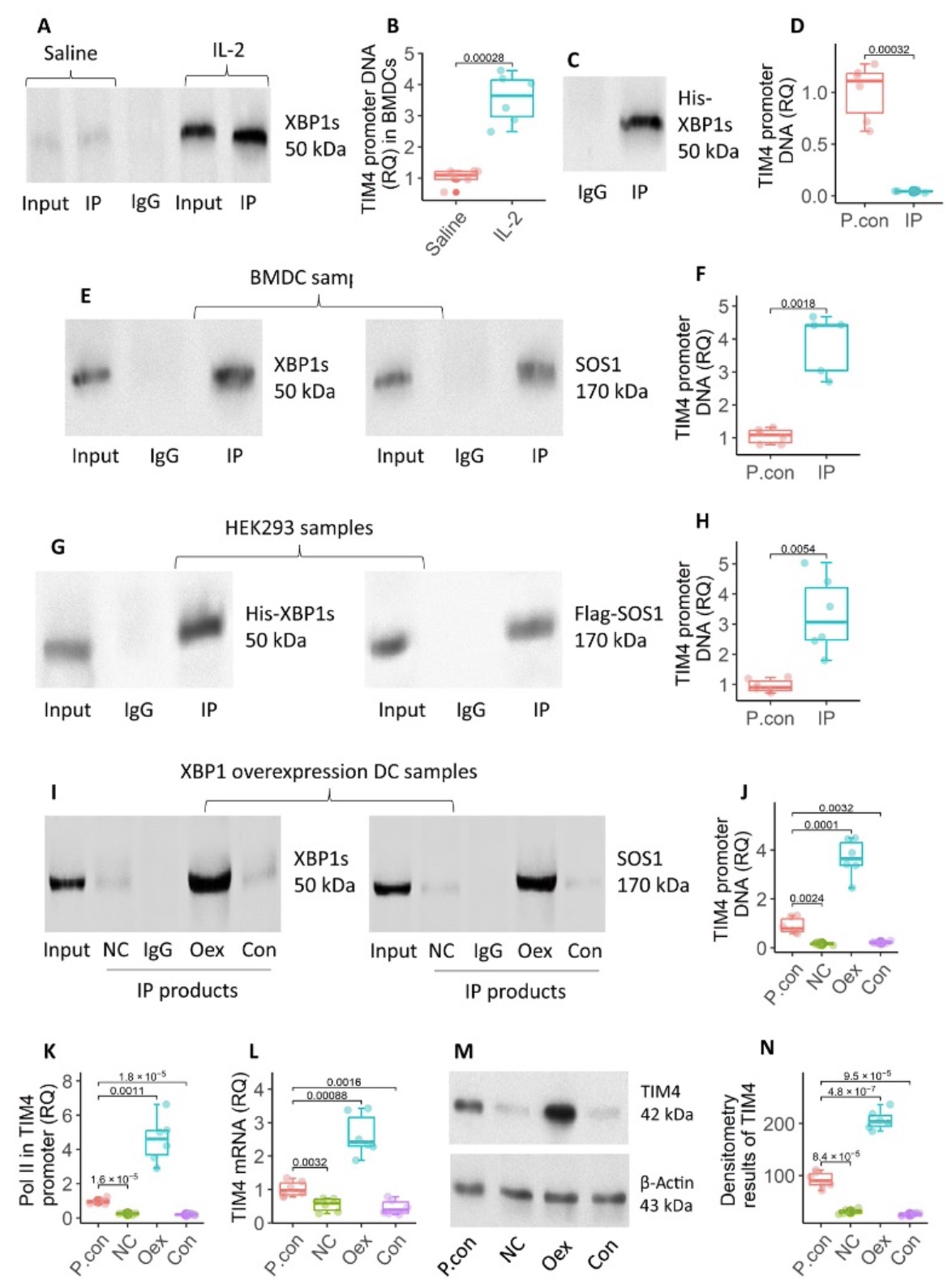
图4 XBP1在诱导DC中TIM4的表达中起关键作用
5. SOS1-RAS相互作用促进DC中XBP1的产生
在上述实验中,抗XBP1抗体免疫沉淀的产物里除XBP1和SOS1外,还鉴定出KRAS,并在Derf1/ pm2.5处理的小鼠DC中发现了XBP1、SOS1和KRAS三方复合体。为了进一步证明三者间的关系,使用Derf1/ PM2.5分别刺激Xbp1ΔDC与Xbp1f/f小鼠,发现Xbp1ΔDC组KRAS-SOS1表达显著减少。同时,在His-XBP1、Flag-SOS1和HA-KRAS质粒共转染的HEK293细胞中发现了相同的趋势。使用法尼基硫代水杨酸(FTS,一种RAS泛抑制剂)能够降低Derf1/ PM2.5刺激下的小鼠DC中XBP1 mRNA和蛋白的表达。因此SOS1-RAS能够上调DC中XBP1的表达。
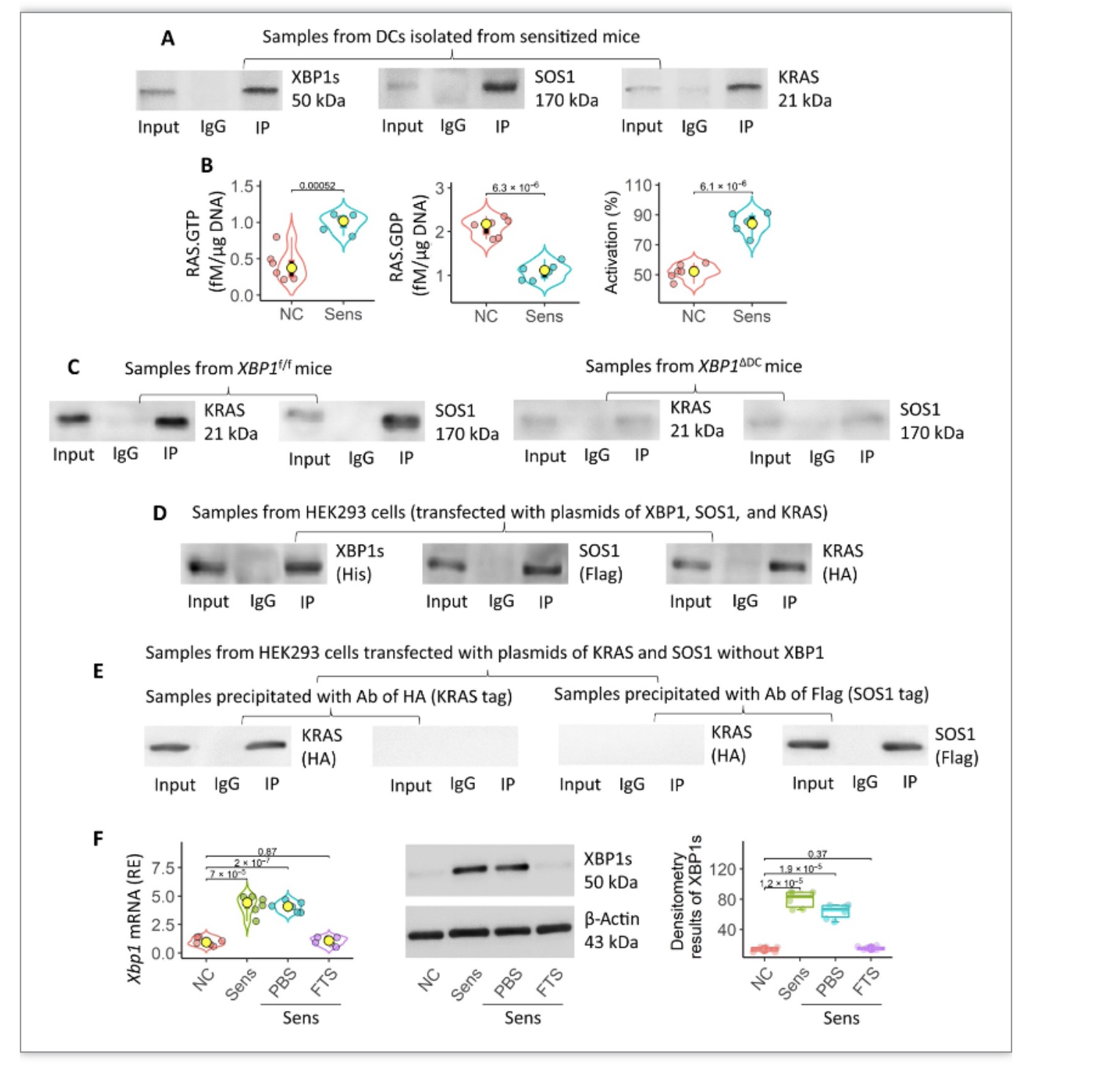
图5 XBP1在诱导DC中TIM4的表达中起关键作用
6. 在DC中靶向XBP1-TIM4通路可预防和减轻异常Th2细胞反应与气道过敏
研究者使用Derf1/PM2.5刺激C57/BL6、Wildtype、Xbp1ΔDC、Tim4ΔDC 与Il2rbΔDC五组小鼠发现,在基因敲除的三组小鼠中鼻痒程度与打喷嚏次数显著减轻,同时检测肺、鼻灌洗液发现这三组的IL-4、IL-5、IL-13、EPX及MCPT1显著减少,血清IgE也呈明显下降趋势。因此认为,靶向XBP1-TIM4通路对于气道过敏的改善具有显著作用。
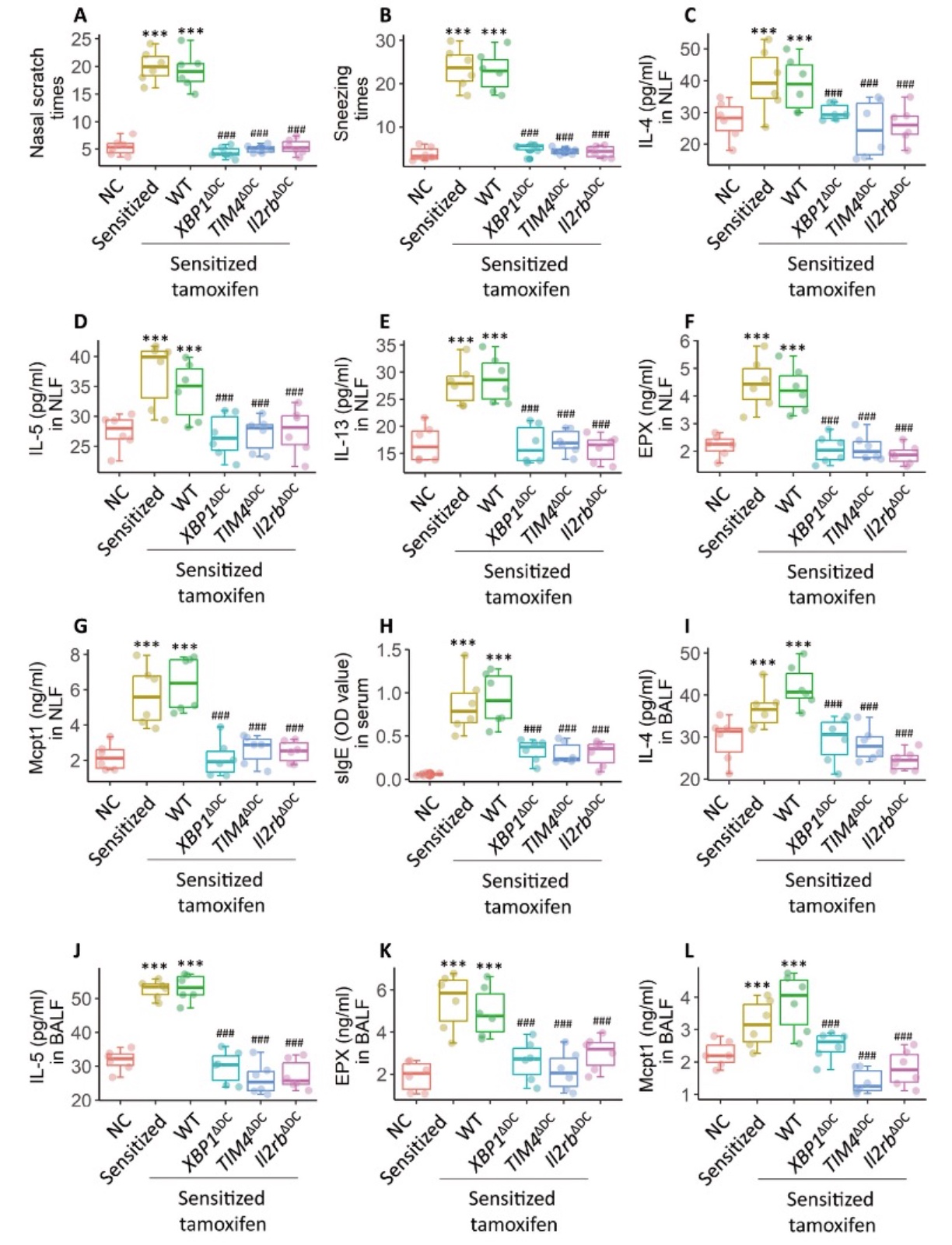
图6 在DC中靶向XBP1-TIM4通路可预防和减轻异常Th2细胞反应与气道过敏
在本研究中作者发现,暴露于Derf1/PM2.5的小鼠诱导气道组织产生IL-2,IL-2诱导DCs产生XBP1, XBP1与SOS1和RAS形成复合物,这是增强TIM4在DCs中的表达所必需的,而TIM4在Th2细胞谱系诱导Th2细胞极化和过敏性疾病中起关键作用,通过阻断XBP1-SOS1-TIM4信号通路可以预防或减轻实验性气道过敏,在治疗过敏性疾病方面具有积极意义。








