神经干/祖细胞(NSPCs)是神经系统中具有自我更新和分化潜能的干细胞。在发育过程中,NSPCs经过一系列对称和不对称的细胞分裂,形成神经系统中重要的功能细胞神经元、星形胶质细胞和少突胶质细胞的群体,这些过程的干扰会导致严重的神经发育和神经精神障碍,给家庭和社会带来巨大的心理和经济负担。因此,在生理和病理条件下深入了解神经发育过程对NSPCs的应用是非常重要的。
出生后,NSPC增殖和神经发生主要在两个特定的大脑区域:海马齿状回(DG)的颗粒下区和侧脑室的室下区(SVZ),并且持续终生[1]。NSPCs的增殖和分化受到微环境、转录因子和表观调节因子等外在和内在信号的调控[2]。研究团队一直致力于神经表观调控的研究,前期的工作证明, 染色质重塑因子ARID1A调控NSPCs的增殖和分化进而影响小鼠胚胎皮层的发育[3]。作为SWI/SNF染色质重塑复合体的核心亚基,ARID1A在兴奋性神经元以及认知中也发挥关键的调节功能[4]。然而,我们仍然不清楚ARID1A在出生后NSPCs和神经发育中的染色质重塑功能。
遗传学研究报道,ARID1A的突变和微重复都会导致Coffin-Siris综合征(CSS),一种以智力障碍和多器官异常为特征的遗传疾病[5]。在早期小鼠胚胎中缺失Arid1a会导致发育停滞和中胚层缺失。Arid1a缺陷损害胚胎干细胞的多能性,抑制自我更新,促进分化为原始内胚层样细胞,表明Arid1a在哺乳动物胚胎发育中起关键作用[6]。尽管Arid1a在胚胎干细胞、神经元祖细胞和有丝分裂后神经元中表现出组成性表达,但由于不同发育阶段染色质重塑SWI/SNF组装体的结构及组分的差异,它可能具有不同的功能。因此,深入探讨Arid1a在神经发育和智力障碍(ID)中的作用和机制具有重要意义。
为了探究Arid1a在神经发育中的功能,研究团队使用Emx1-Cre条件性敲除小鼠在皮层和海马中特异性敲除Arid1a。 cKO小鼠的组织学分析显示出生后21天海马结构明显异常(图1A, C),缺乏齿状颗粒细胞层,锥体层排列紊乱(图1A)。然后,研究团队检测了出生前(E16.5和E18.5)和出生后(P0, P7, P14和P21) Arid1a cKO小鼠的颗粒细胞层(GCL)。在尼氏染色的切片中,Arid1a cKO小鼠的DG区域在E16.5到E18.5之间差异不明显,而在P0时期其GCL区域面积明显小于WT小鼠(图1B)。随着年龄的增长,cKO和WT小鼠之间的GCL区域面积的差异进一步扩大(图1B, C)。这些数据表明Arid1a对DG的发育至关重要。
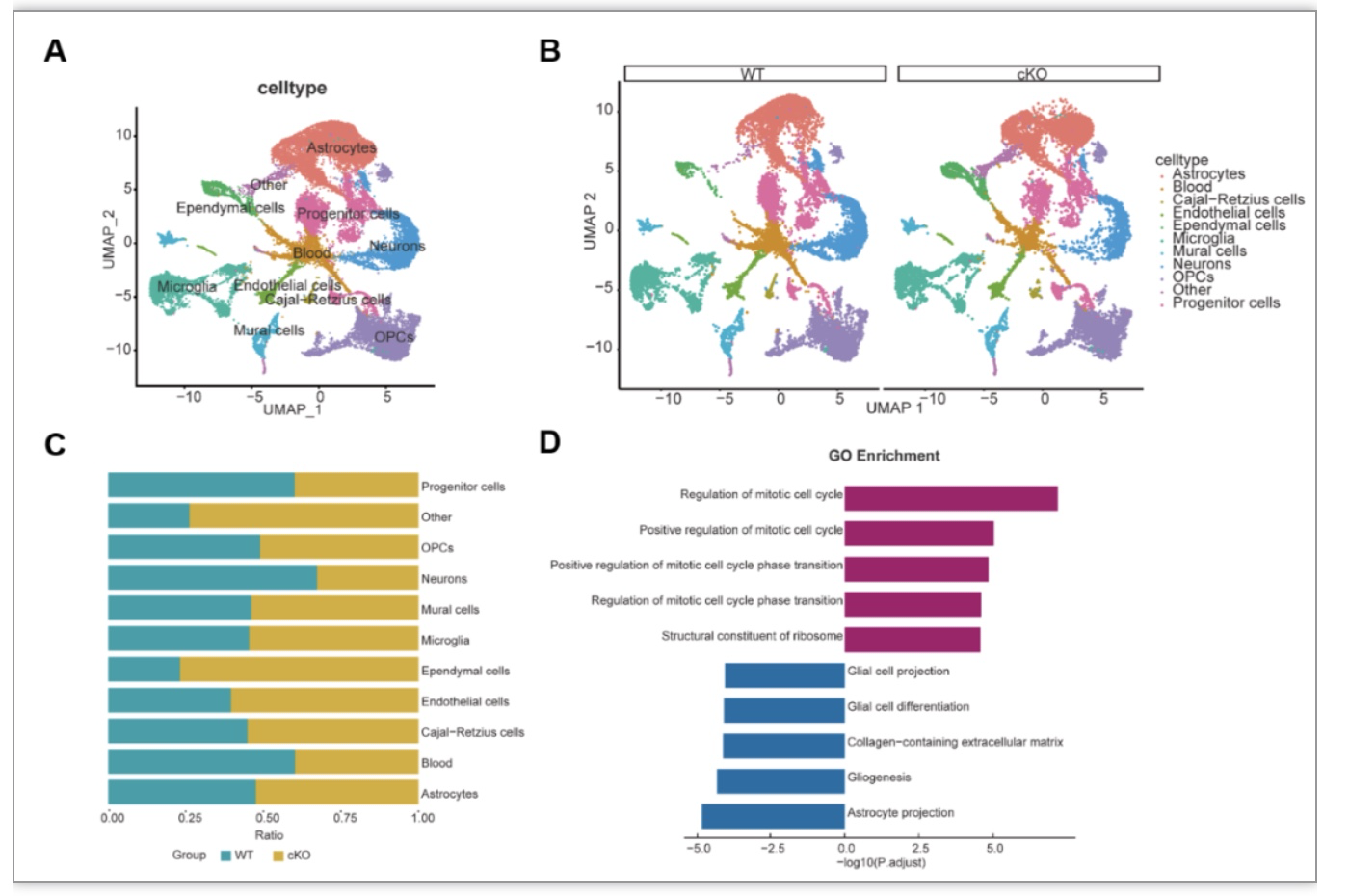
为了揭示WT和Arid1a cKO小鼠海马细胞组成的差异,研究团队利用单细胞测序鉴定了海马区域11种主要的细胞类型,并进行了比较分析(图2A)。值得注意的是,与WT小鼠相比,在cKO小鼠中,神经祖细胞和神经元的相对百分比下降了10%-20%(图2B,C)。通过差异基因分析,在神经祖细胞中的差异基因与有丝分裂细胞周期、细胞周期相变和细胞分化等通路密切相关(图2D)。这些数据表明,与WT海马相比,Arid1a cKO海马中NSPCs的增殖可能发生了改变。
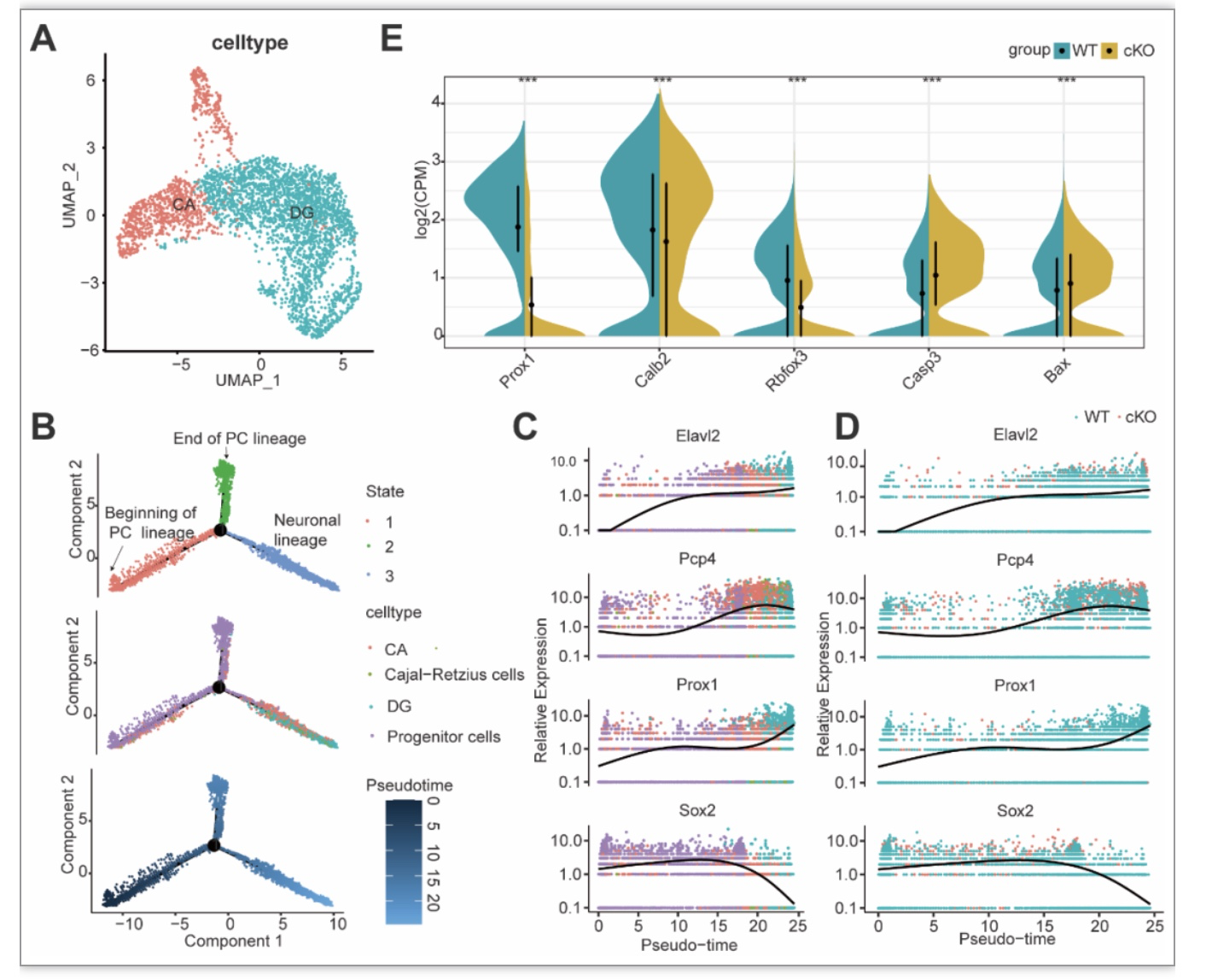
为了进一步研究WT和cKO海马中神经元的差异,研究团队根据已知的细胞类型和发育标志物确定了CA和DG两个细胞亚群(图3A,B)。通过拟时序分析,发现Elavl2、Pcp4、Prox1的表达沿着从神经祖细胞到神经元的伪时间顺序路径逐渐上调,Sox2的表达下调(图3C)。且WT和cKO小鼠相比,cKO小鼠DG神经元中Prox1的表达明显降低。而CA标记物Elavl2、Pcp4在Arid1a cKO小鼠中较WT小鼠略有降低(图3D)。此外,研究团队发现DG神经元中与颗粒细胞发育、神经元分化相关的基因Prox1、Calb2、Rbfox3表达降低,而与细胞凋亡相关的基因Casp3和Bax的表达升高(图3E)。综上所述,在神经细胞命运决定期间,Elavl2, Pcp4, Prox1顺序激活,并证实了Arid1a cKO小鼠DG中细胞分化和细胞凋亡的强烈变化。
为了探究ARID1A敲除导致的SWI/SNF复合体靶向的下游分子机制的变化,研究团队利用E16.5的海马组织开展了H3K4me3, H3K27me3,H3K27ac修饰的ChIP-Seq分析,结果表明,这三种组蛋白修饰主要富集在蛋白质编码基因的转录起始点周围。研究团队进而将H3K27ac和H3K4me3修饰下调的基因与单细胞测序的差异基因进行了联合分析,并通过ChIP-qPCR确定Prox1为Arid1a直接下游靶基因。Prox1过表达可以逆转Arid1a缺失导致的NSPCs增殖和分化减少的表型(图4 A-D)。这些结果表明,Prox1是Arid1a调节NSPCs增殖和分化的功能性下游靶点。
图4 过表达Prox1可挽救Arid1a cKO海马神经干/祖细胞的增殖和分化缺陷
本研究综合分子、细胞和转录组分析,首次揭示了ARID1A通过介导特定位点组蛋白修饰来调控海马区神经干/祖细胞向神经元谱系转变中的重要功能。有证据表明,ARID1A在特定的细胞类型中增强了许多转录因子或其它重要基因的染色质重塑,因此,研究团队重点探究其在特定的神经谱系细胞(如NSPCs)中的作用,为未来能够获得特异治疗CSS的药物靶点提供理论依据。