脊髓损伤(Spinal cord injury,SCI)的再生修复一直是再生医学领域的热点和难点,目前临床上仍缺乏有效的治疗及康复方法。SCI具有发病率高,治疗费用高,致残率高,发病年龄低等特点,会造成患者及其家庭巨大的生理、心理和经济负担。据报道,中国共有759,302名外伤性SCI患者,且每年约有66,374个新增病例[1]。
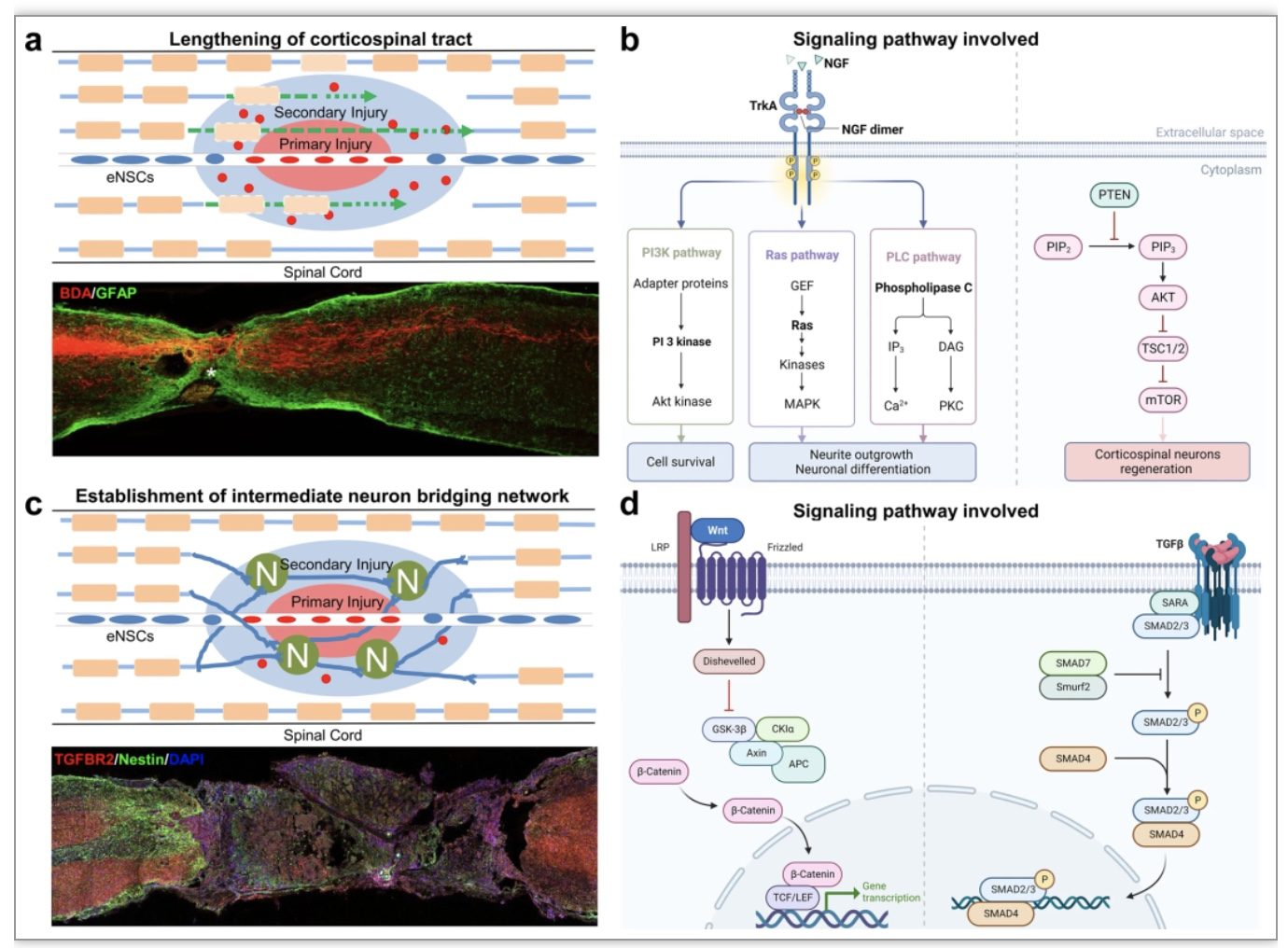
SCI后神经功能的恢复取决于神经环路的完整性和可塑性,神经元轴突的断裂和神经元的死亡导致神经回路功能紊乱,因此神经环路的可塑性是神经功能恢复的基础。传统的修复原则是促进皮质脊髓束(CST)的再生和延伸,重新建立与远端神经元的联系,经典的如PTEN基因的缺失可有效增强成年皮质脊髓神经元的再生能力,促进了SCI后运动功能的恢复[2]。近年研究发现,中间神经元可能为近端和远端神经元提供桥梁并形成新的神经环路[3],已成为SCI修复的研究重点,而这些关键的中间神经元可能来自于脊髓原始中间神经元、移植的干细胞或内源性NSCs(eNSCs)分化出来的细胞(图1)。
图1. SCI后神经环路重建的两种主要修复策略及相关信号通路
(图源: Xiao Hu et al., Signal Transduct Target Ther, 2023)
SCI可分为原发性及继发性损伤,损伤后内源性神经干细胞和免疫细胞被大量激活,病理进程异常复杂,这使得神经环路的重塑异常困难,对SCI病理机制的分析有助于发现更多的关键干预目标。然而,SCI的病理机制犹如一个“黑匣子”,至今仍不完全清楚。此外,不同类型细胞在SCI中的作用,如免疫细胞、星形胶质细胞、小胶质细胞等,也存在争议。近年来,借助多组学的方法对SCI的分子病理机制有了更深度的解析,并且随着生物活性材料、干细胞、物理调控等领域的发展,综合治疗策略得到广泛开发,其中一些已用于临床研究与治疗,显示出良好的应用前景。
综上,解析SCI病理发生发展的分子机制,了解SCI治疗及干预新策略,对于推进SCI修复研究与临床药物开发,进一步改善国民健康至关重要。因此,深入探讨并总结近年SCI的研究与临床进展具有重要的意义。
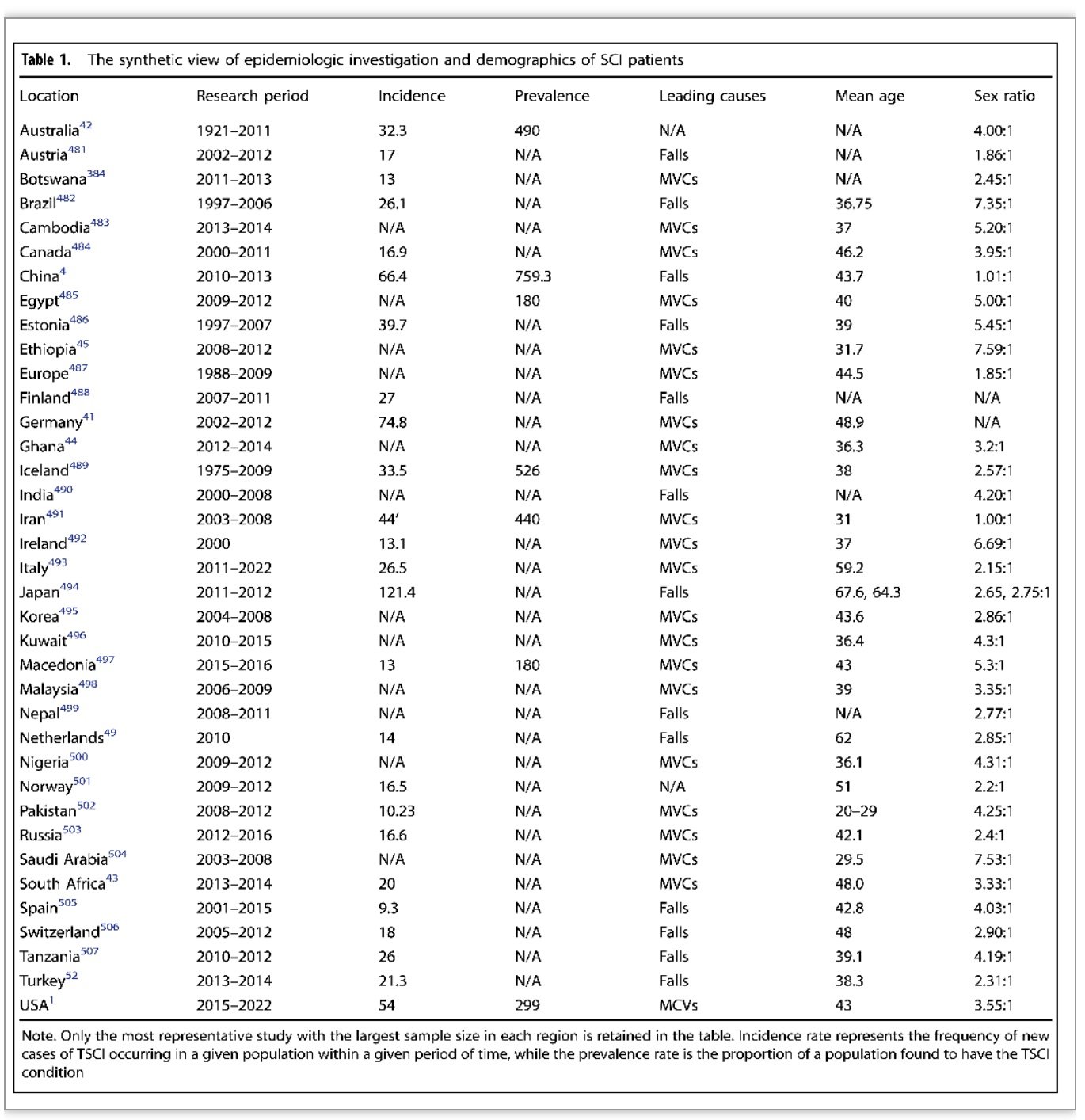
世界各国SCI发病率和人口统计学特征进行分析,发现不同国家的SCI发病率差异巨大,发展中国家的SCI发病率较低,而发达国家的SCI发病率较高。其中,车祸和跌倒是最常见的受伤原因,并且SCI高发于年龄小于50岁和男性人群(表1)。
(表源: Xiao Hu et al., Signal Transduct Target Ther, 2023)
损伤后会依次经历急性期、亚急性期和慢性期。脊髓缺血、血管性水肿和谷氨酸兴奋性神经毒性在急性期发生,而神经炎症、线粒体磷酸化和NOS的产生在亚急性期发生,凋亡坏死、轴突变性、轴突髓鞘化和胶质瘢痕形成在慢性期发生。SCI后大多数变化发生在损伤后3天,到第14天会出现第二波小胶质细胞激活,伴随着包括神经元在内的各种细胞类型的变化[4]。到第38天,主要的细胞类型仍然与未受伤的状态有很大偏差,显示出长期的改变(图2)。
(图源: Xiao Hu et al., Signal Transduct Target Ther, 2023)
免疫反应是一个关键的病理机制,可能决定SCI的预后。当SCI发生时,局部小胶质反应和血脊屏障的破坏为血源性免疫细胞提供了机会,包括中性粒细胞、单核巨噬细胞和淋巴细胞等进入脊髓组织。这些细胞分泌促炎或免疫调节因子,参与免疫反应。免疫反应一直被认为有破坏作用,不利于SCI的修复。然而,免疫反应在SCI损伤的发展和再生修复中的作用仍有争议。在SCI的病理生理过程中,所有的神经功能细胞都会产生病理反应,而且神经细胞和炎症细胞之间也有异常活跃的神经交流。分析这些重要功能细胞的反应和交流机制,有助于理解SCI的病理机制,并提供关键的调控目标。
对SCI的病理机制进行序贯研究,可以为治疗提供干预方向。SCI后存在一种自发的修复机制,但它面临许多阻力,需要外部的干预来进一步提高修复能力。生物活性物质可以为神经再生提供营养因子或调节细胞代谢,干细胞可以有效分化以取代凋亡的神经细胞,生物活性材料和物理调节方法可以调节SCI部位的细胞命运(图3)。这些方法可以促进新生神经元或中间神经网络的形成,从而有利于SCI的功能恢复。
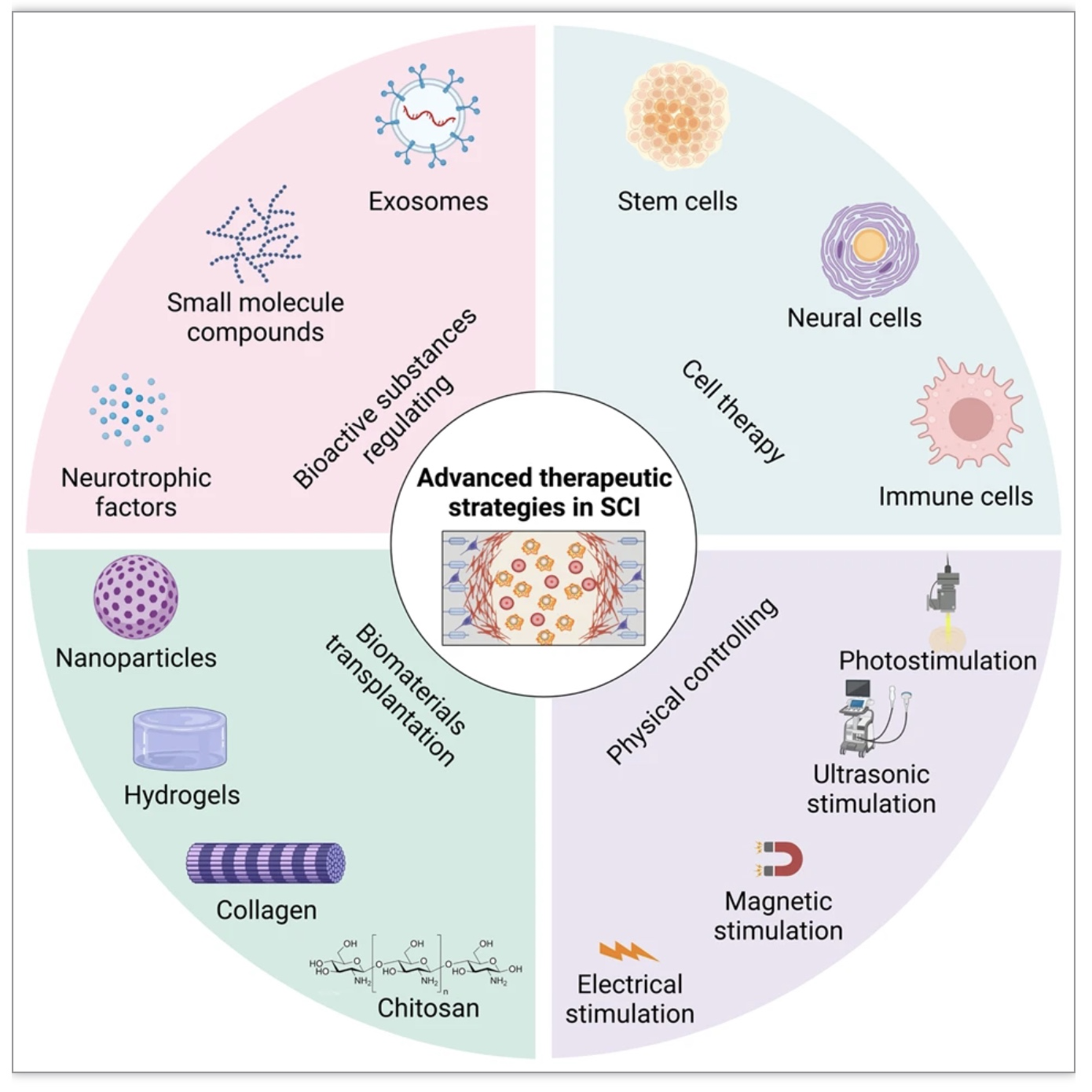
(图源: Xiao Hu et al., Signal Transduct Target Ther, 2023)
生物活性物质包括神经营养因子、小分子化合物和外泌体等已被广泛用于SCI研究,它们都显示出通过促进轴突再生和改善微环境恢复SCI功能的能力[5]。另一方面,移植细胞可以分化或分泌各种因子,调节炎症反应,提供营养支持,促进轴突再生和神经修复[6]。此外,生物活性材料作为载体用于靶向给药,增加循环时间可提高药物的生物利用率。最近,许多生物材料被设计出来,并在内源神经干细胞的激活、动员和调控分化方面显示出优势[7]。最后,在损伤的慢性期,可通过光、声、磁、电等物理调控手段促进神经功能的代偿性恢复。近来,这些策略的综合运用已成为研究的热点,通过多种手段的干预有望实现更好的协同修复作用。
SCI的临床治疗方法包括药物、手术、康复和护理等。急性期的干预主要是为了稳定病情,保证病人的存活。慢性期的干预主要是为了恢复功能,减少并发症,并鼓励病人回归社会和工作。
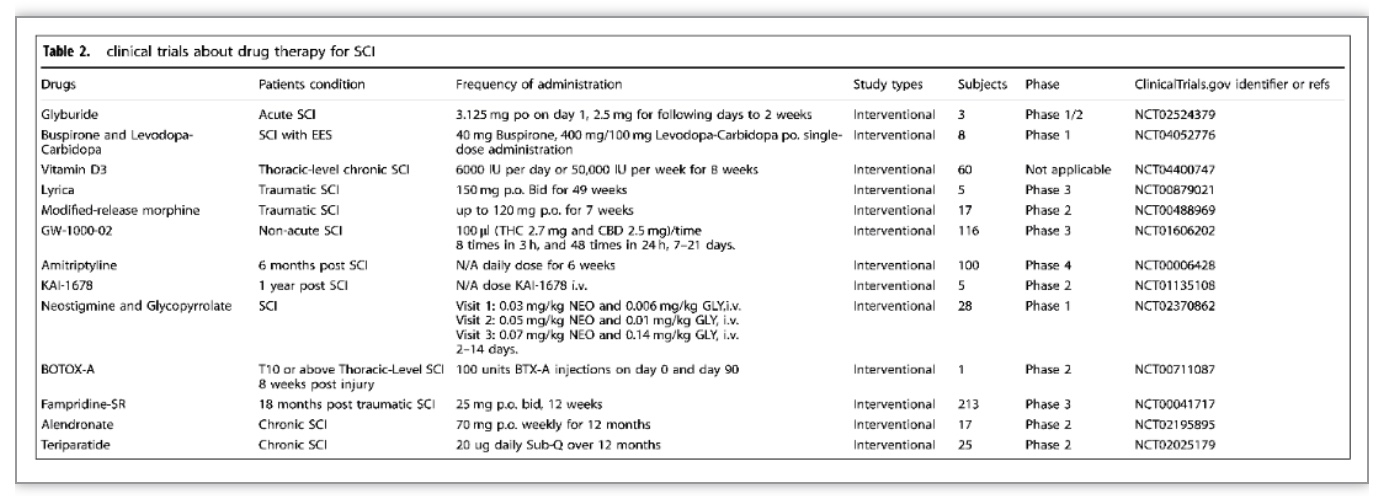
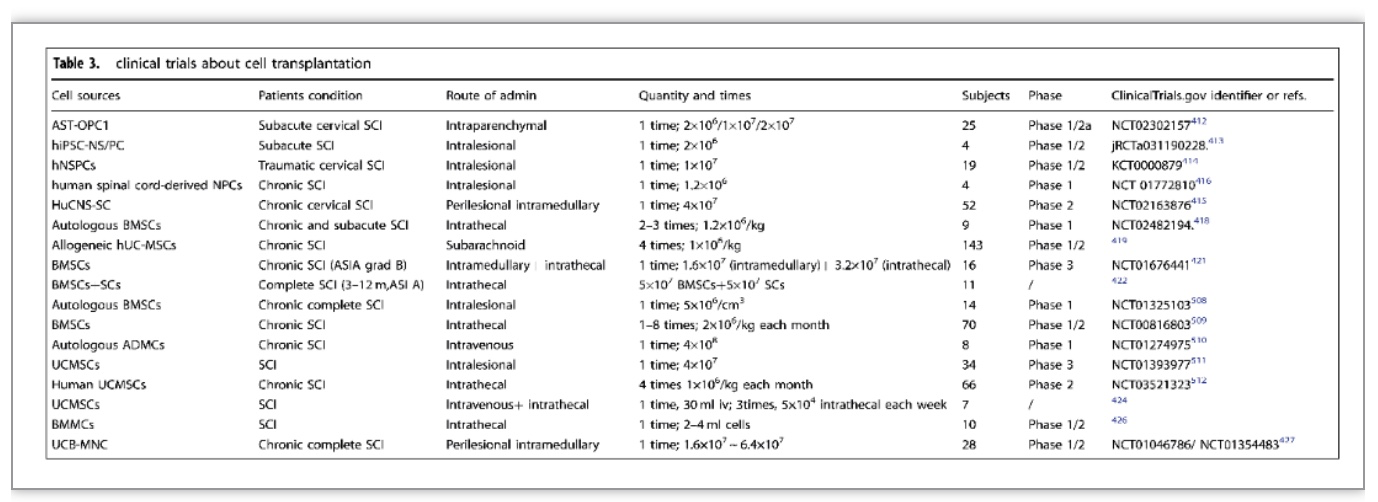
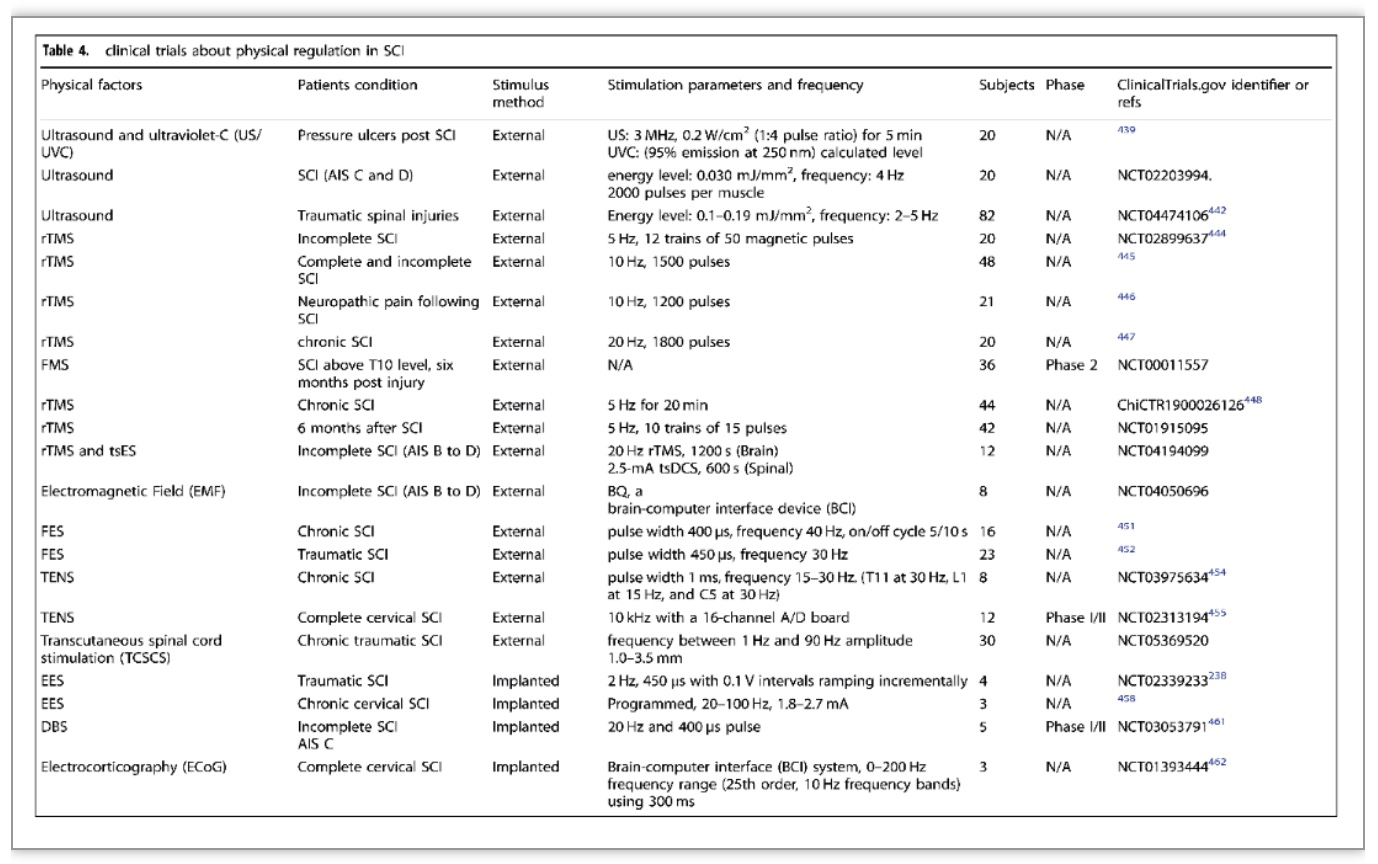
临床治疗的突破主要集中在新药研发、手术疗法、细胞疗法、生物材料移植的临床试验、新的物理调控方法等。治疗SCI的新药临床试验正在不断进行中,研究主要集中在SCI后的神经再生和微环境调节,这些药物包括甘草酸、丁螺环酮联合左旋多巴-卡比多巴、维生素D3等(表2)。其次,急性SCI手术的目的是减压和恢复脊柱序列和稳定性,早期减压手术如硬脊膜切除术和硬脊膜成形术可降低椎管内压力,达到减轻神经损伤和改善预后的目的,还可减少ICU住院时间和减少医疗并发症。另外,细胞移植修复SCI被认为是最有前途的治疗策略,移植的细胞类型包括MSCs、OECs、OPCs、NSCs/NPCs、ESCs和iPSCs。自体干细胞移植的免疫原性和致瘤性风险低,而异体细胞易于获得和扩增,便于质量管理。因此细胞移植应考虑大规模制造的安全性、效率、成本和可行性(表3)。物理调控方面,这一领域的大多数临床试验都与经颅磁刺激和硬膜外电刺激有关。在不完全性SCI的情况下,每天15次的高频经颅磁刺激可以改善下肢的运动评分、行走速度和痉挛[8]。硬膜外电刺激(EES)作为一种侵入性电刺激技术,通过手术将电刺激装置放置在与目标区域相对应的硬膜外区域。四名慢性运动完全SCI患者通过EES结合康复治疗实现了独立站立和躯干稳定[9]。在另一项研究中,三名严重慢性颈椎病患者通过定向脊髓刺激用植入的脉冲发生器实现自主控制行走[10]。这些研究表明,EES是一种非常有前途的治疗SCI的方法(表4)。此外,高压氧、运动、神经调节功能性电刺激、外骨骼机器人和脑-电接口等物理辅助治疗也是临床SCI重要的研究方向。
(表源: Xiao Hu et al., Signal Transduct Target Ther, 2023)
(表源: Xiao Hu et al., Signal Transduct Target Ther, 2023)
(表源: Xiao Hu et al., Signal Transduct Target Ther, 2023)
SCI各种病理机制具有时间和空间上的独特特征,它们之间又相互联系,相互影响,难以准确描述和阐述。全面和深入解析SCI病理机制,尤其不同神经细胞和免疫细胞在损伤进展中的作用,有助于为SCI治疗策略提供新的思路。本文对SCI的多个方面进行了全面阐述,作者也提出了现有治疗策略的局限性,比如有必要进一步优化SCI的临床研究,由于SCI患者的异质性较高,个体差异较大,可适当缩小纳入窗口,采用客观的生物学指标衡量损伤的严重程度,并采用较为准确的SCI预后分析系统。此外,虽然干细胞的安全性和有效性已在动物实验中得到证实,但仍然需要更多的临床前研究来评估干细胞治疗的安全性和有效性。更重要的是,干细胞的临床转化研究需要社会、政策和法律的支持。作者也指出随着新技术的发展,未来的研究需要促进各领域的合作,形成手术和生物康复相结合的综合治疗技术体系,以取得更多突破。