黑色素瘤是由黑色素细胞来源的一种恶性肿瘤,多发生于皮肤,也可见于粘膜、内脏、软脑膜等处,是一种死亡率高、转移率高且治疗难度大的恶性肿瘤[1]。由于实体瘤微环境具有高度的复杂性及多样性,免疫治疗如PD-1/PD-L1免疫检查点抑制剂单独使用在部分患者群体疗效显著,绝大多数患者因对其响应率较低而无法达到预期治疗效果[2]。根据肿瘤微环境(tumor microenvironment, TME)中免疫细胞的浸润分布情况可将肿瘤的免疫微环境分为免疫炎症、免疫排除及免疫荒漠表型[3],其中免疫排除及免疫荒漠表型均被认为是非免疫炎症表型,因效应性免疫细胞不能有效的在TME中浸润,导致免疫应答低下及肿瘤免疫逃逸[4],更重要的是其与免疫治疗效能密切相关。细胞因子如白细胞介素、干扰素、趋化因子等是TME中细胞之间通讯的关键介质,发挥着重要的免疫应答调控及抗肿瘤作用。白介素如IL-12、IL-2等可激活效应T细胞及NK细胞,促进Th1细胞分化及IFN-γ产生,其单独或联合治疗在多种肿瘤中表现出有效的抗肿瘤作用[5,6]。IFN-γ可诱导细胞产生CXCL-9、CXCL-10等趋化因子,募集免疫细胞浸润至TME中,其在TME中的分布及含量直接影响到肿瘤的发生及进展[7,8]。因此深入认识并阐明肿瘤微环境内的分子机制,对黑素瘤的治疗及预后具有重要意义。
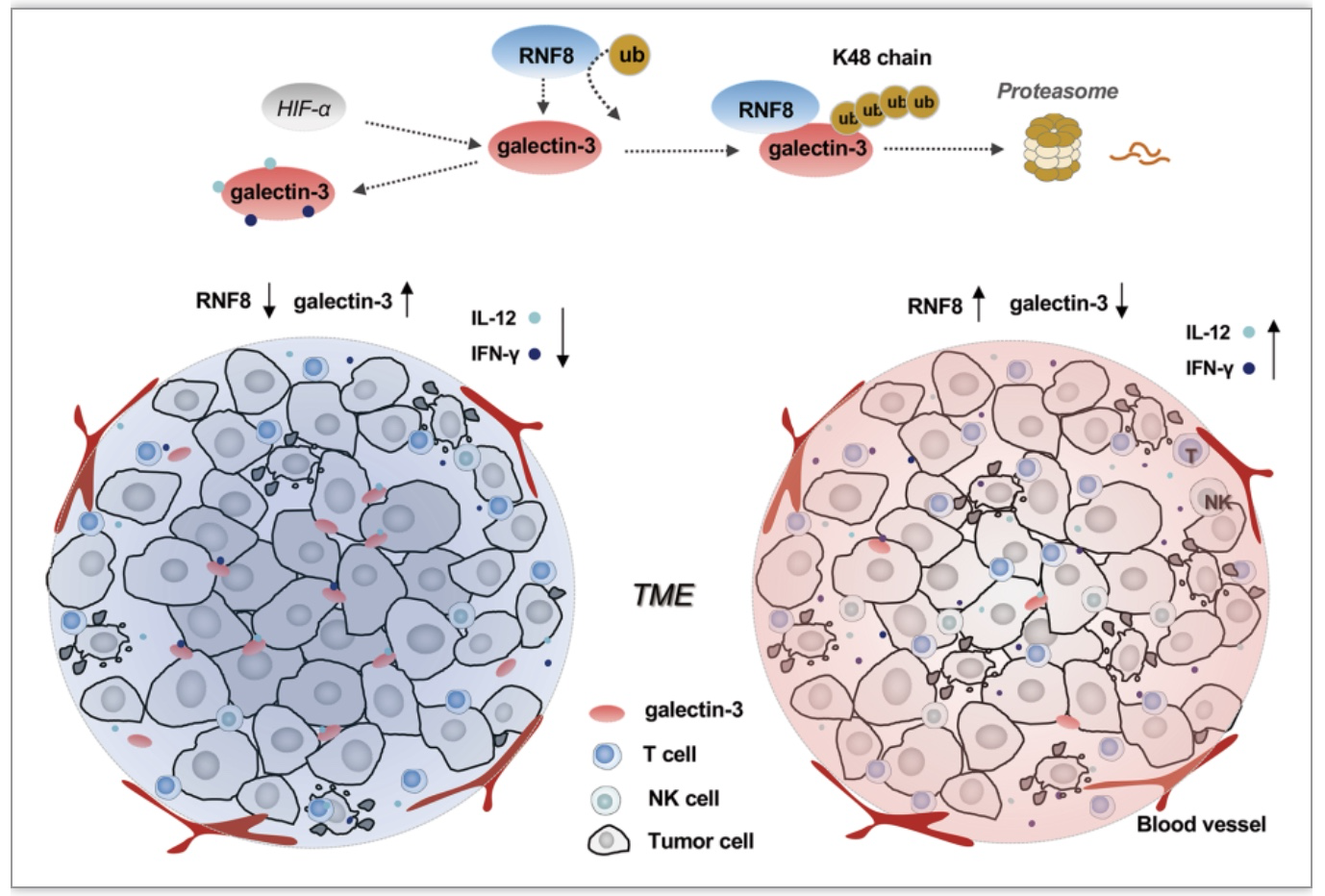
该研究基于泛素化修饰组学找到并鉴定出RNF8通过k48多泛素化修饰galectin-3,并经泛素蛋白酶体系统促进galectin-3的降解,从而抑制galectin-3与IL-12和IFN-γ的结合,影响趋化因子的产生及免疫细胞的浸润,以调控TME内免疫应答及肿瘤的免疫逃逸,并且galectin-3抑制剂联合PD-L1抑制剂治疗可有效增强免疫疗法的治疗效果。
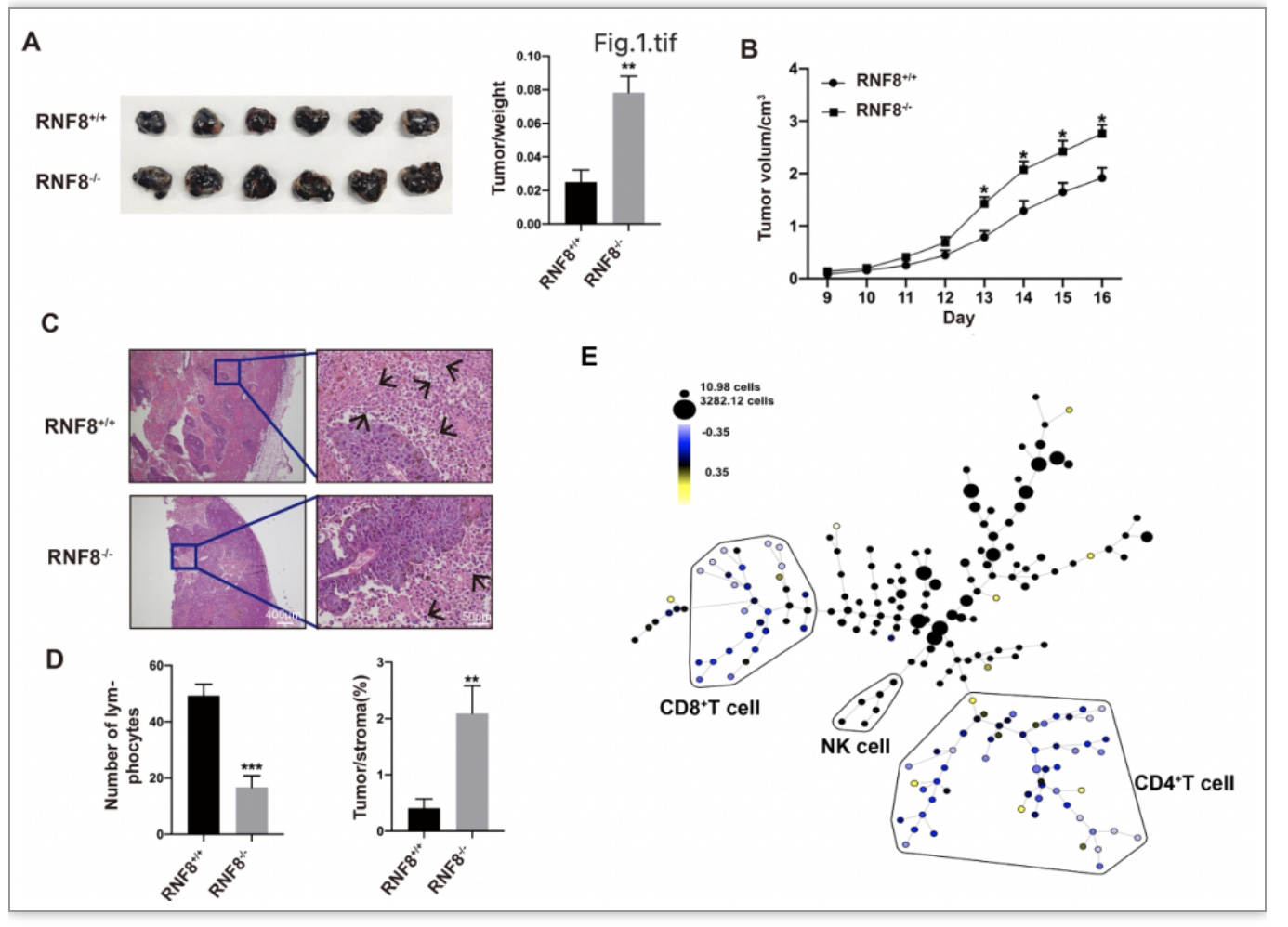
RNF8-KO小鼠肿瘤生长速度较WT快,组织病理学显示种植瘤内瘤细胞生长密集、间质比例明显降低、淋巴细胞浸润减少 (Fig1 A-D);质谱流式及western blot结果显示KO组瘤内CD3、IFN-γ水平下降,尤其是CD4+和CD8+T细胞下降明显(Fig1E),进一步证实了RNF8缺失影响黑色素瘤的进展。
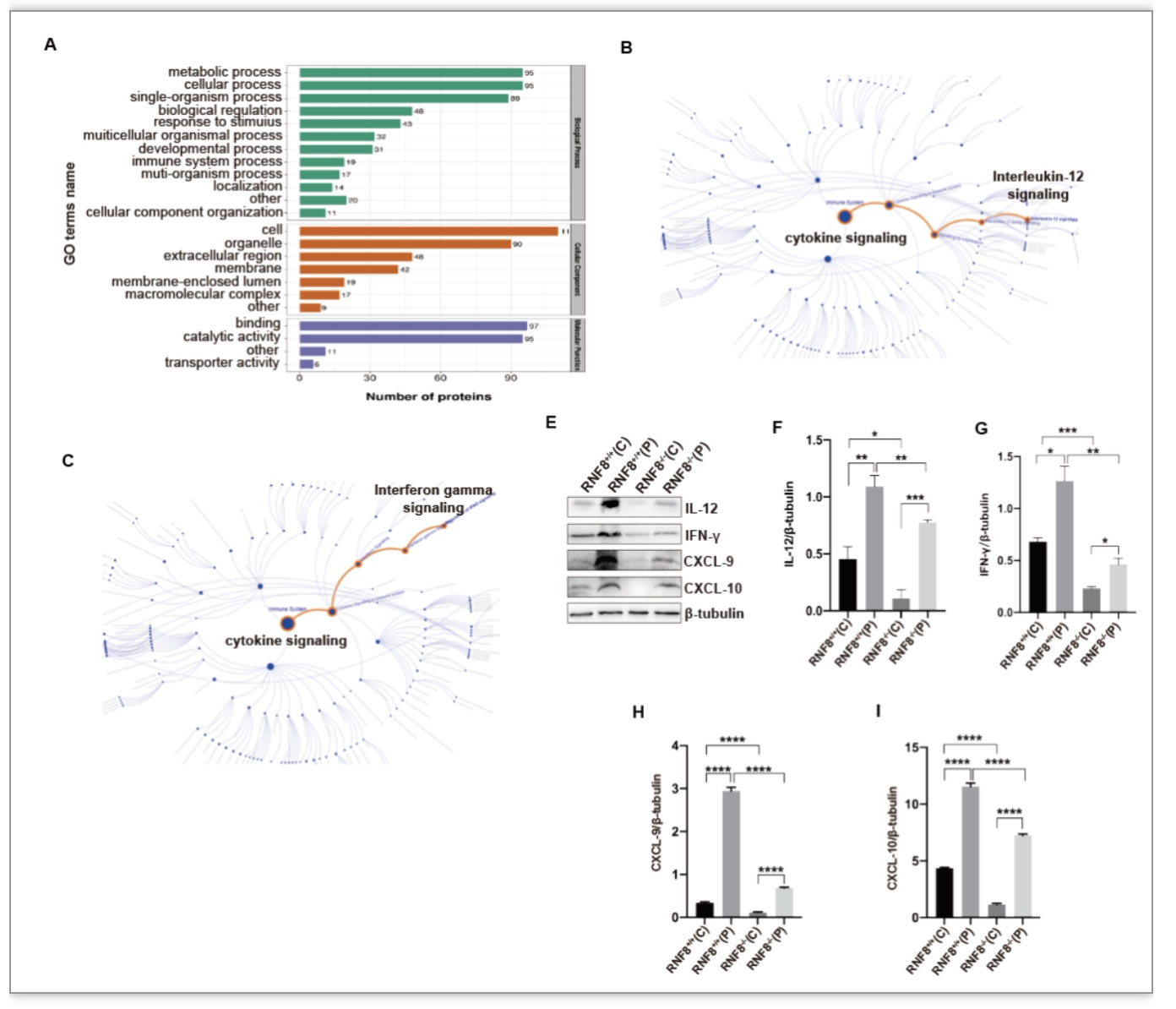
RNF8修饰组学显示RNF8调控IL-12和IFN-γ免疫信号通路(Fig2A-C),通过将肿瘤区域划分为肿瘤中央和肿瘤边缘发现CD3、IL-12、IFN-γ、CXCL-9、CXCL-10在肿瘤中央区域表达较低,且KO组瘤内边缘与中央部免疫因子和免疫细胞的表达水平皆低于WT组(Fig2D-H)。干湿实验皆证明了RNF8参与炎症信号通路的调节。
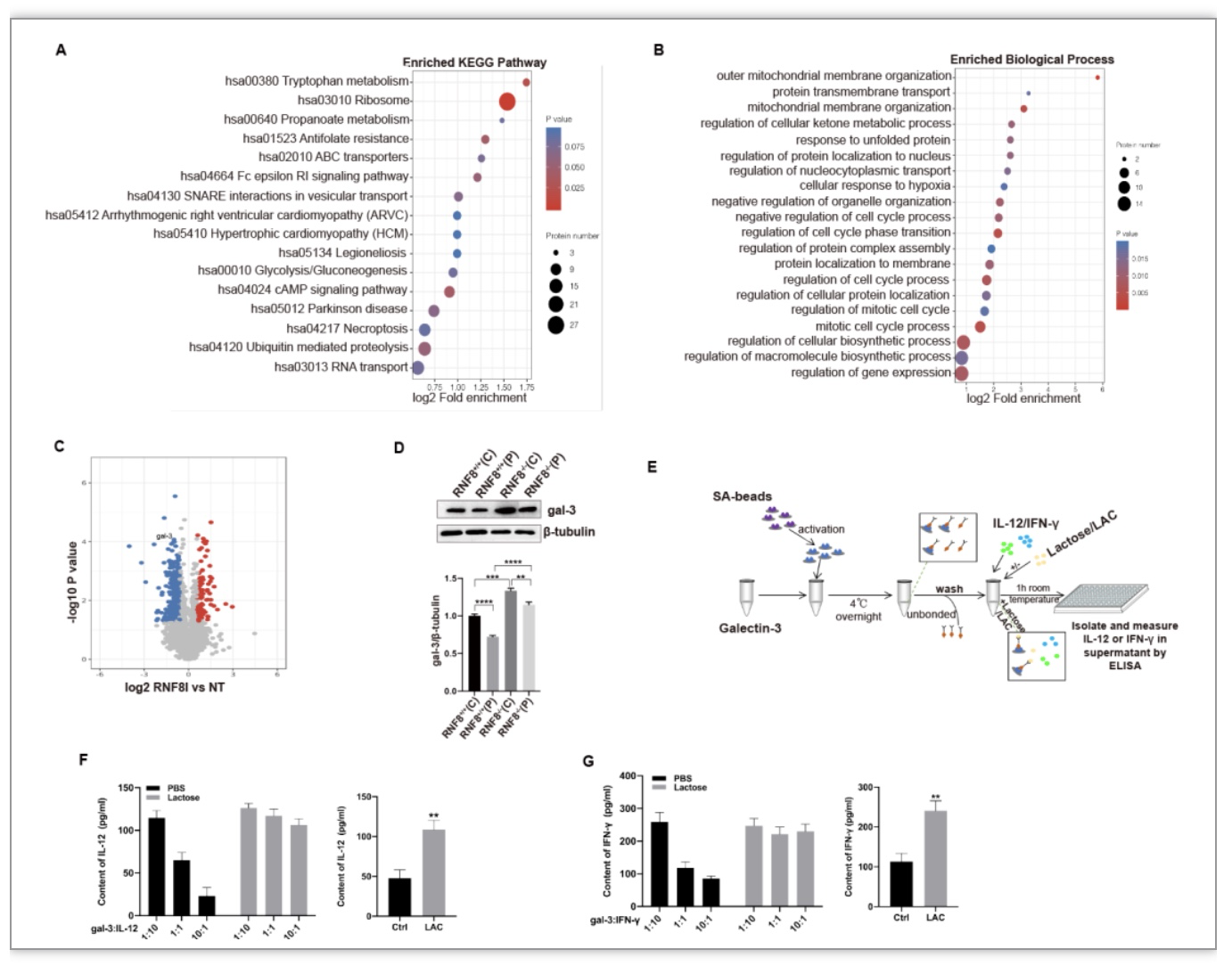
修饰组学分析发现RNF8缺乏与免疫、ubi-偶联途径和细胞内信号转导有关(Fig3A-C)。在这些基因中,gal-3是一种参与与多种蛋白质结合的凝集素,被选中进行进一步的研究,在RNF8-/-小鼠中galectin-3的表达增加,并且肿瘤中央区域的galectin-3高于边缘区域(FIg3D),此表达模式与IL-12、IFN-γ和CD3的表达模式相反,而galectin-3可以结合IL-12和IFN-γ(Fig3E-G),从而影响下游趋化因子及免疫细胞向肿瘤的浸润。该研究表明RNF8通过影响galectin-3介导免疫信号通路。
图3. RNF8经galectin-3影响免疫信号通路
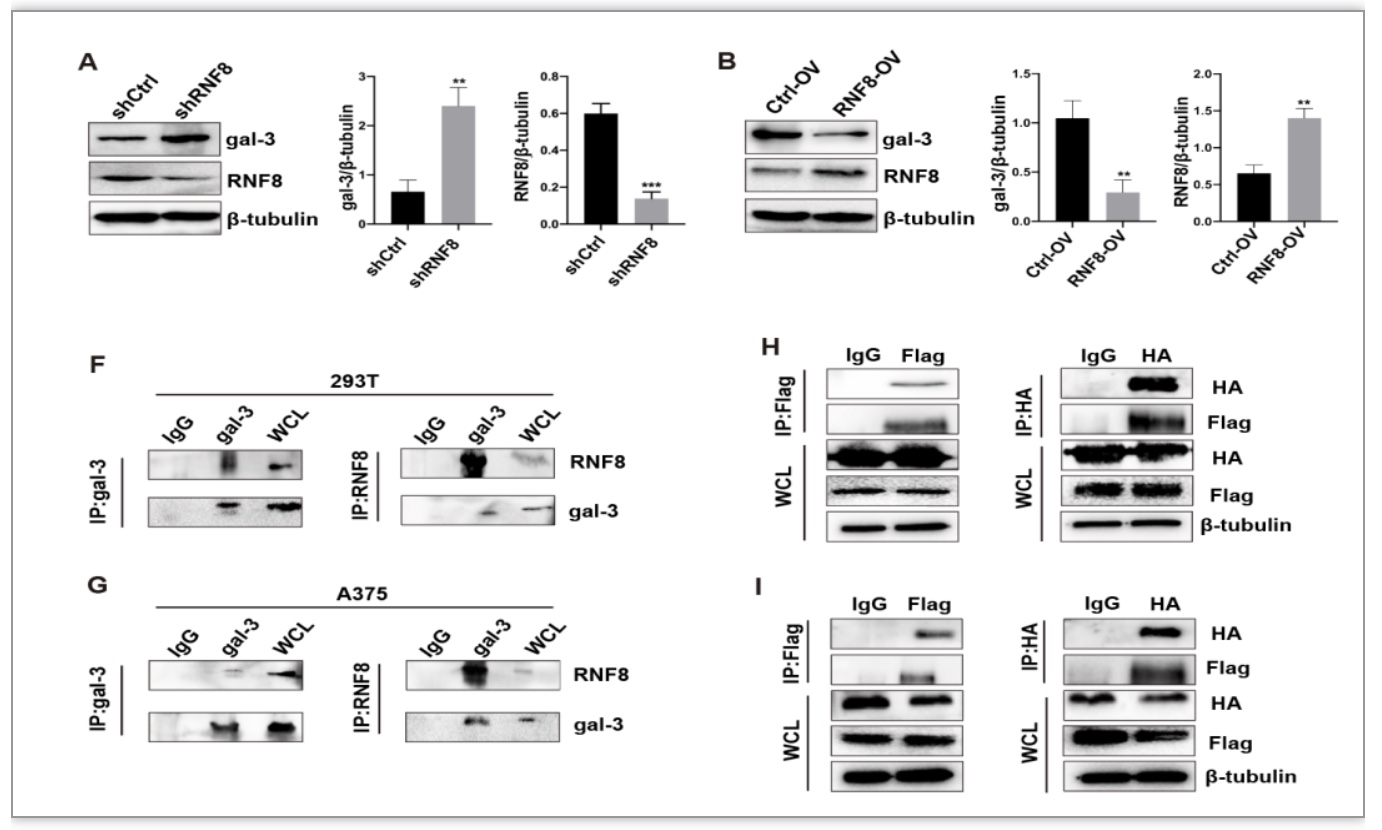
RNF8敲低后,galectin-3显著增强相,相反,RNF8过表达导致galectin-3的抑制(Fig4 A-B),RNF8与galectin-3呈现负相关关系。通过co-IP实验分别验证了内源性与外源性的RNF8和galectin-3的互作反应(Fig4C-F)。研究表明E3泛素连接酶可以与galectin-3相互作用,且两者为负相关关系。
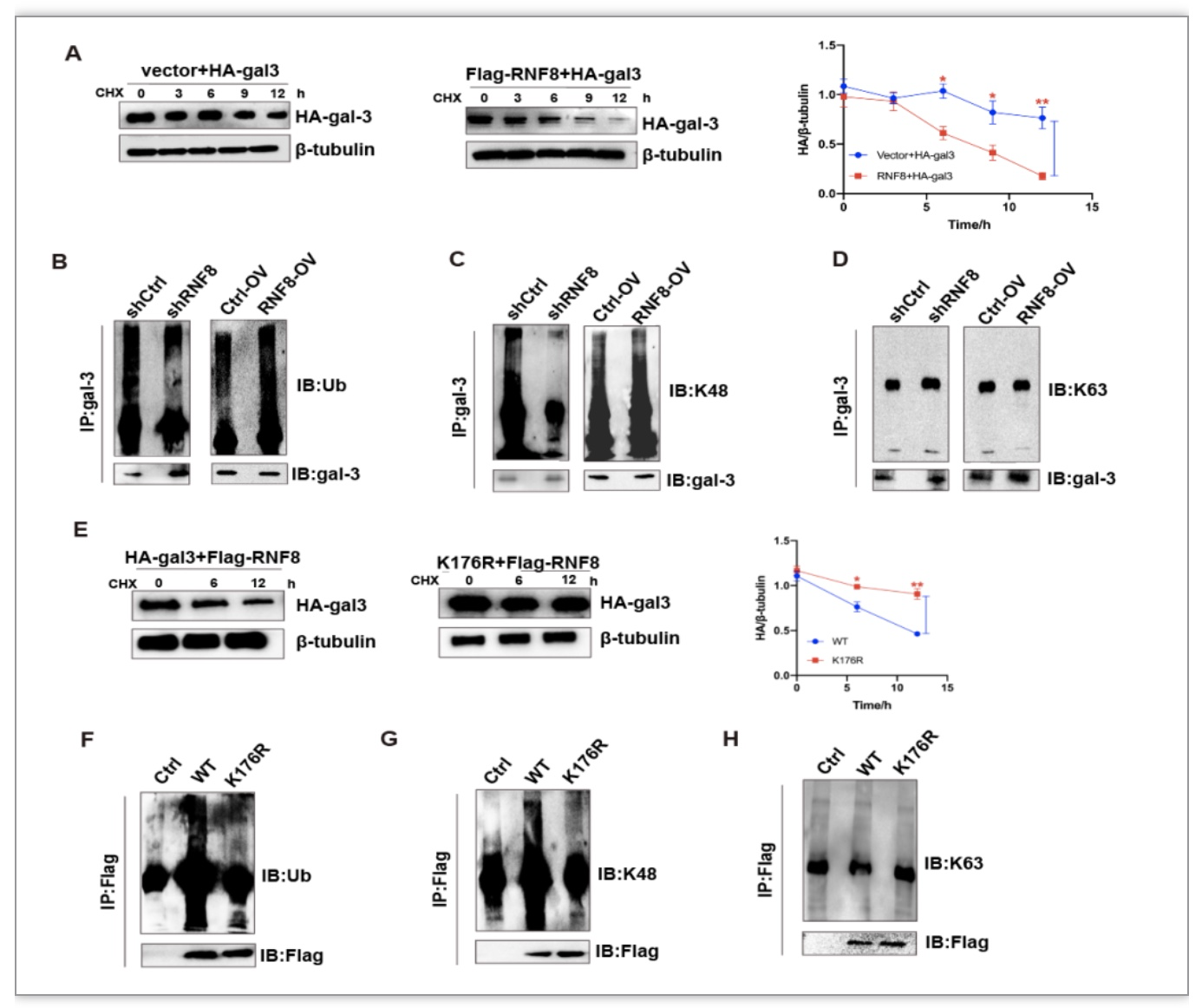
环己亚胺(CHX)实验表明,外源性补充RNF8以时间依赖性的方式显著增强了外源性galectin-3的降解(Fig5A)。在RNF8敲低细胞中gal-3的总泛素化、K48类型的泛素化水平显著降低,RNF8过表达则增强了gal-3的总泛素化及K48泛素化水平,而K63类型的泛素化水平无明显变化(Fig5B-D)。随后通过质谱检测出galectin-3发生泛素化的重要位点K176,将其突变后RNF8不再影响galectin-3的降解(Fig5E)。Galectin-3的突变体K176R总泛素化、K48类型泛素化水平显著的被抑制(Fig5F-H)。研究表明RNF8通过K48连接多泛素链修饰galectin-3并经蛋白酶体途径降解。
图5. RNF8经K48连接的多泛素链修饰galectin-3
Gaiectin-3抑制剂联合PD-L1抑制剂治疗黑色素瘤可显著缩小肿瘤体积、减缓肿瘤增殖速度、增强瘤内免疫因子及免疫细胞的浸润(Fig6A-E)。通过研究黑色素瘤内微环境的分子关系,galectin-3抑制剂有望成为PD-L1抑制剂疗法提高黑色素瘤疗效的增敏剂,并增强免疫检查点疗法的响应率。
图6. 抑制galectin-3促进PD-L1抑制剂对黑色素瘤的敏感性
综上所述,RNF8经介导galectin-3的多聚泛素化修饰降解,调控galectin-3与细胞因子的结合,以调控肿瘤微环境内免疫细胞的浸润及肿瘤细胞的免疫逃逸,维持TME的稳态。此外,借助刺激免疫应答来增强抗肿瘤作用,对推动新型免疫药物的开发及肿瘤治疗具有重大意义,通过“先攻城”--解除TME对免疫系统的抑制,即阻断galectin-3对细胞因子的结合,“再杀敌”--增强自身免疫的同时联合免疫检查点抑制剂干预,协同增效免疫细胞功能,治疗肿瘤。对于靶向galectin-3是否增敏PD-L1免疫检查点疗法仍需构建小鼠CDX及PDX肿瘤模型继续深入研究,并且缺乏临床数据的支持,因此对于二者联合治疗黑色素瘤的效果仍需进一步探究。