该研究基于与ICD相关的基因构建了一个与ICD相关的GBM分层模型,评估了不同分层患者的肿瘤微环境,并筛选出与ICD相关的标记用于构建预后评分模型,然后评估了该模型的准确性和应用价值。进一步评估了风险评分与免疫细胞浸润、免疫功能、肿瘤突变负荷、肿瘤干细胞评分、药物敏感性和肿瘤免疫治疗反应之间的相关性。这有助于为未来的GBM研究和临床管理提供新的思路。

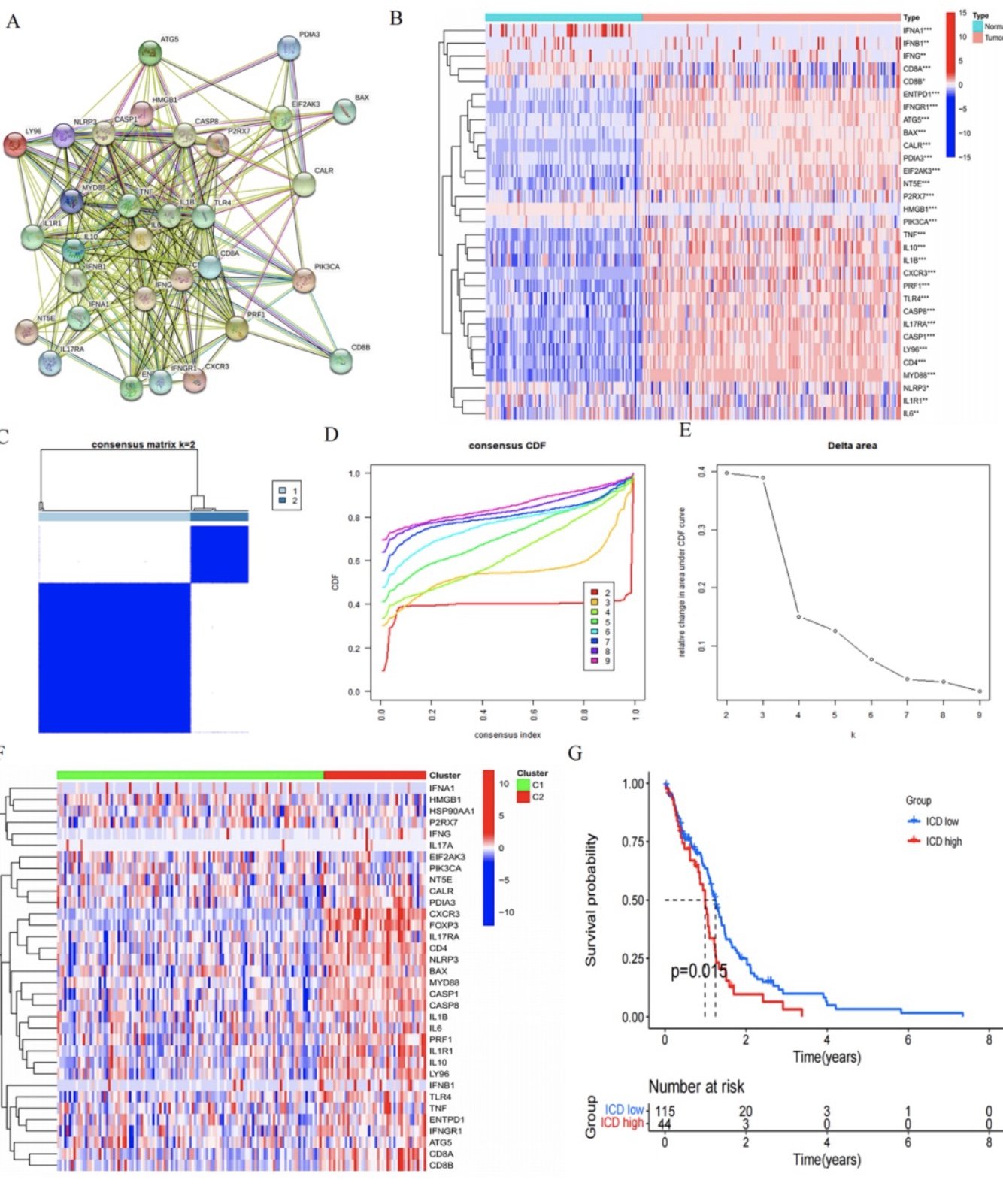
研究者从训练集中提取了一个包含34个ICD相关基因的矩阵。通过在STRING数据库中构建蛋白质相互作用网络,我们确定了32个ICD差异表达基因(ICD-DEGs),以进一步阐明它们之间的关联关系。(图1A)热图显示,在胶质瘤中,大多数ICD基因的表达水平显著上调,除了IFNA1、CD8A和HMGB1在正常样本中显著上调外,FOXP3和HSP90AA1的表达水平在正常和癌症样本之间没有显著差异。(图1B)有趣的是,我们发现大多数ICD相关基因在C2簇中表达水平较高(图1C-E),暗示了ICD高簇。相反,C1簇的表达水平较低,暗示了ICD低簇(图1F)。此外,生存分析表明ICD低簇的患者具有更好的生存结果(log-rank检验 P=0.0015)(图1G)。

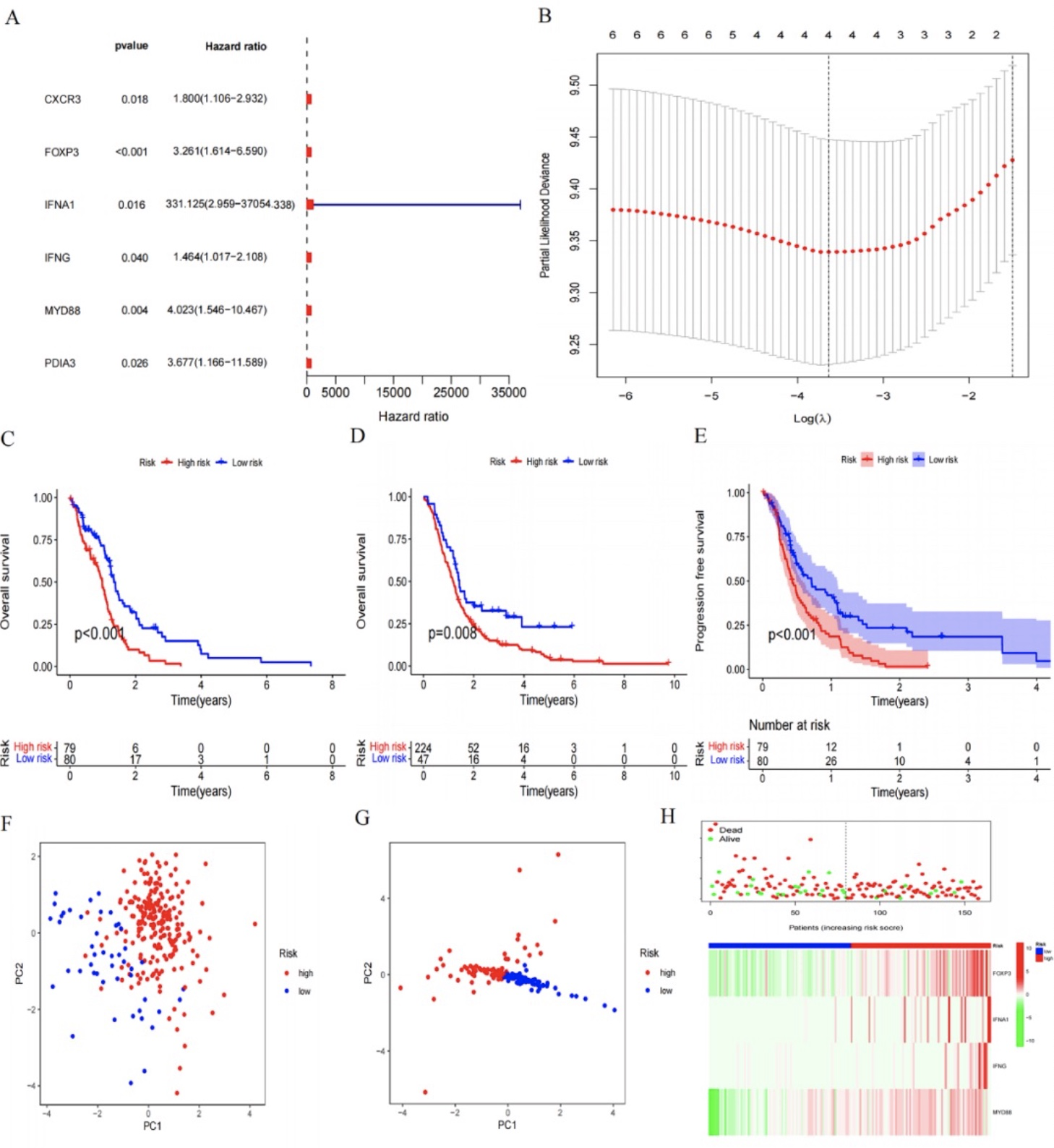
基于65个差异表达基因(DEGs),进行单变量COX回归分析以确定与光束状瘤多形性脑胶质瘤(GBM)患者的总生存(OS)相关的ICD相关DEGs。其中有6个与ICD相关的DEGs被认为是预后相关基因(图4A)。最终,在LASSO回归分析中识别出了4个与ICD相关的DEGs。随后,研究者使用这四个DEG构建了预测模型(图4B)。风险评分模型的算法公式如下:Risk score = (0.6422)*FOXP3 + (4.5648)*IFNA1 + (0.1994)*IFNG + (0.8709)*MYD88。对训练集和验证集中的每位患者计算了风险评分。根据训练集中患者评分的中位数,将患者分为高风险组和低风险组。生存曲线显示低风险组的生存时间显著更长(在训练集中log-rank检验P < 0.001;在测试集中P = 0.008)(图4C、D)。此外,低风险组的无进展生存期也比高风险组长(图4E)。主成分分析显示训练和测试队列中低风险亚组与高风险亚组之间存在显著差异(图4F、G)。在训练集和测试集中,高风险组和低风险组的风险评分、生存状态以及风险标识的lncRNA表达之间存在显著差异(图4H)。

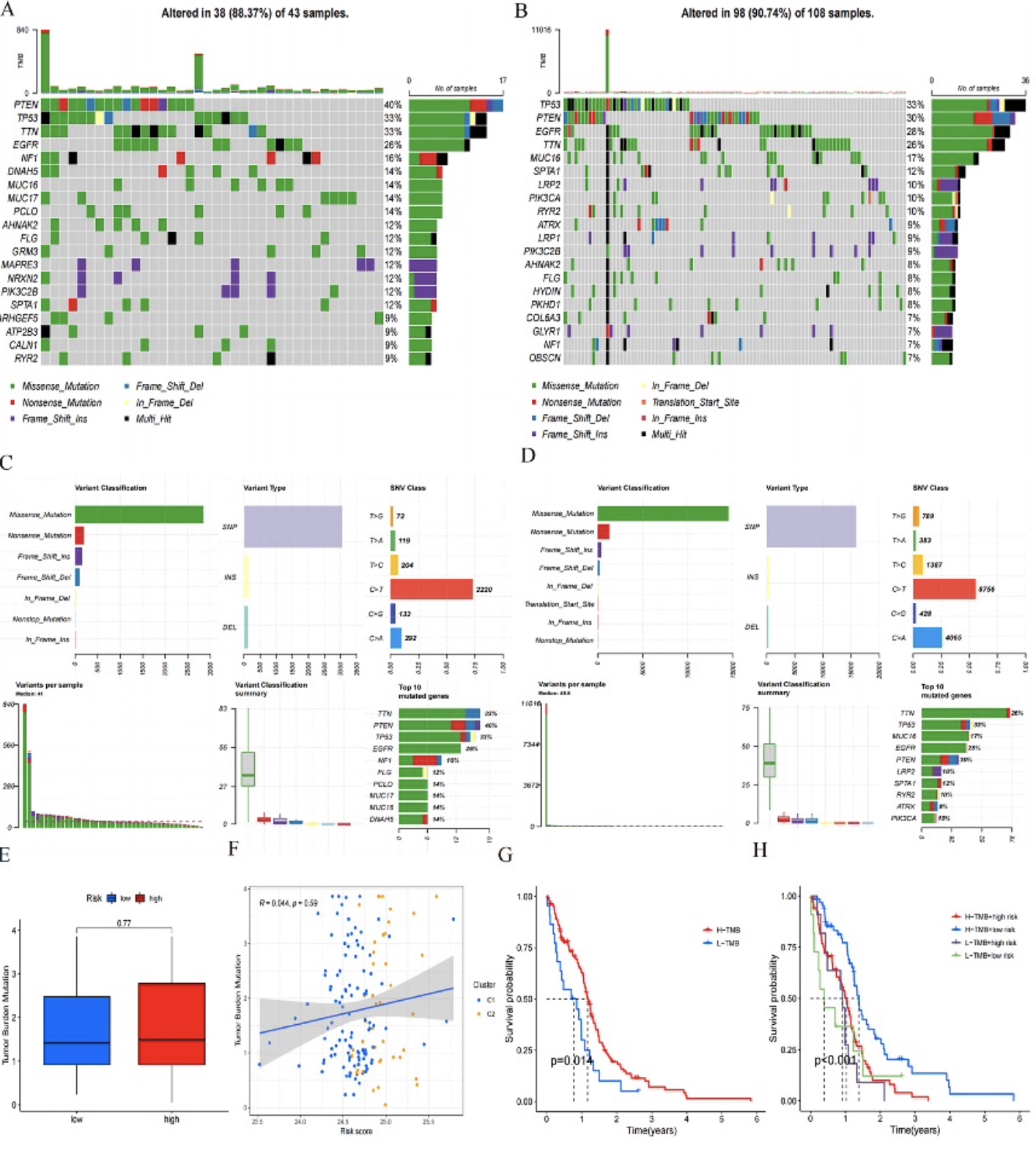
为了探索高风险和低风险组之间的差异,研究者分析了体细胞突变数据。结果显示,高风险组的43个样本中有38个(88.37%)存在遗传突变,而低风险组108个样本中有98个(90.74%)存在遗传突变。(图6A,B)在低风险组中,TP53(33%)是突变频率最高的基因,其次是PTEN(30%)、EGFR(28%)和TTN(26%)。在高风险组中,PTEN(40%)是突变频率最高的基因,其次是TP53(33%)、TTN(33%)和EGFR(26%)。同时,在两组中,错义突变在变异分类中排名最高,SNP在变异类型中排名最高,C > T在SNV类别中排名最高。(图6C,6D)然而,两个风险组之间在肿瘤突变负荷(TMB)上没有显著差异,并且TMB与风险评分之间没有显著关系 (R = 0.044, P = 0.59)(图6E,F)。根据TMB的中位数,将患者分为高TMB组和低TMB组,生存分析显示,高TMB组的患者存活时间明显更长(P = 0.014)(图6G)。随后,作者进一步考虑风险评分。生存曲线显示,高TMB与高风险组、高TMB与低风险组、低TMB与高风险组以及低TMB与低风险组之间的存活预后存在显著差异 (P < 0.001),表明除了TMB外,风险评分是GBM患者的独立预后因子(图6H)。此外,研究者进行了药物敏感性分析,评估了多种药物的IC50值,并发现对低风险和高风险组敏感的药物之间存在显著差异。
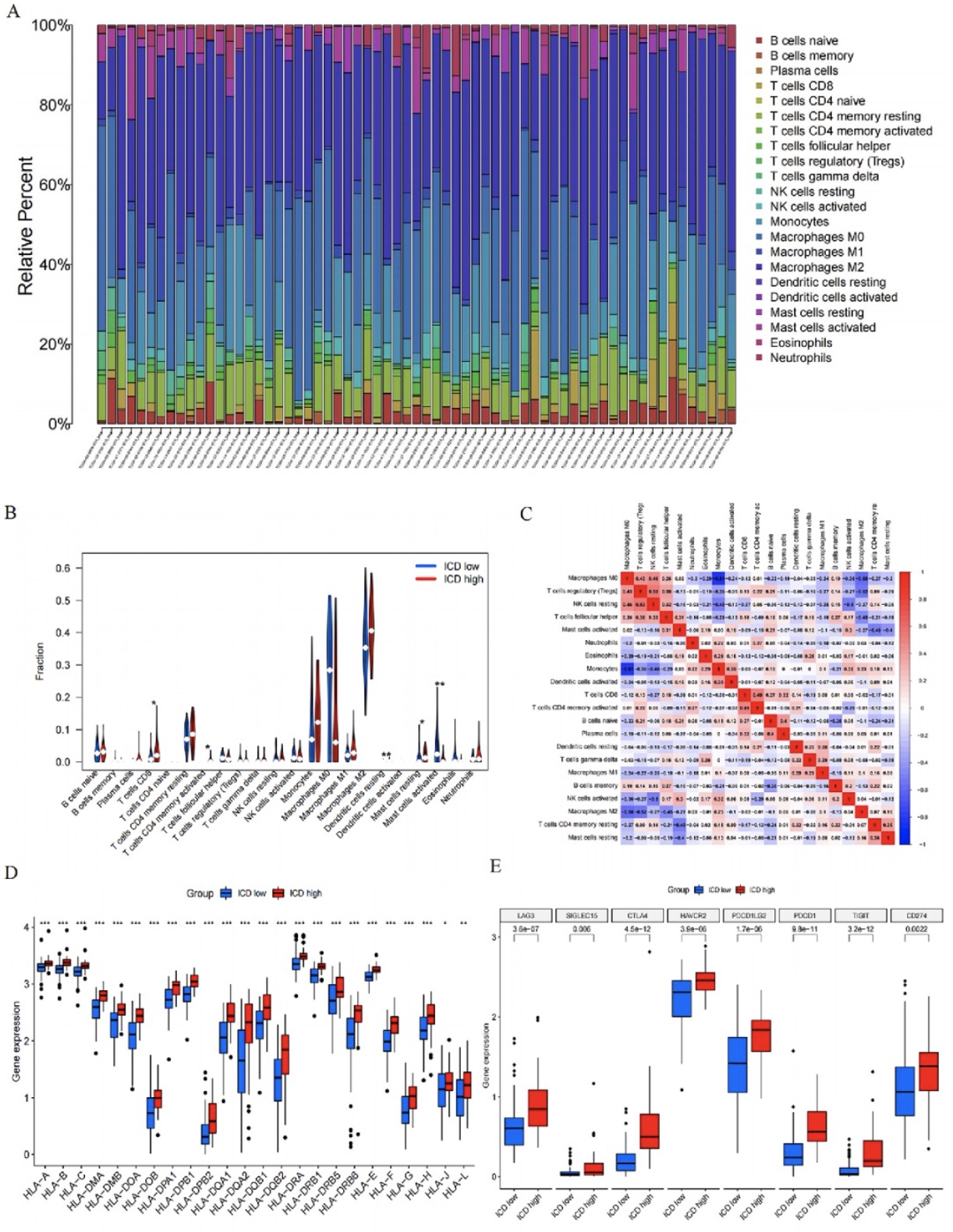
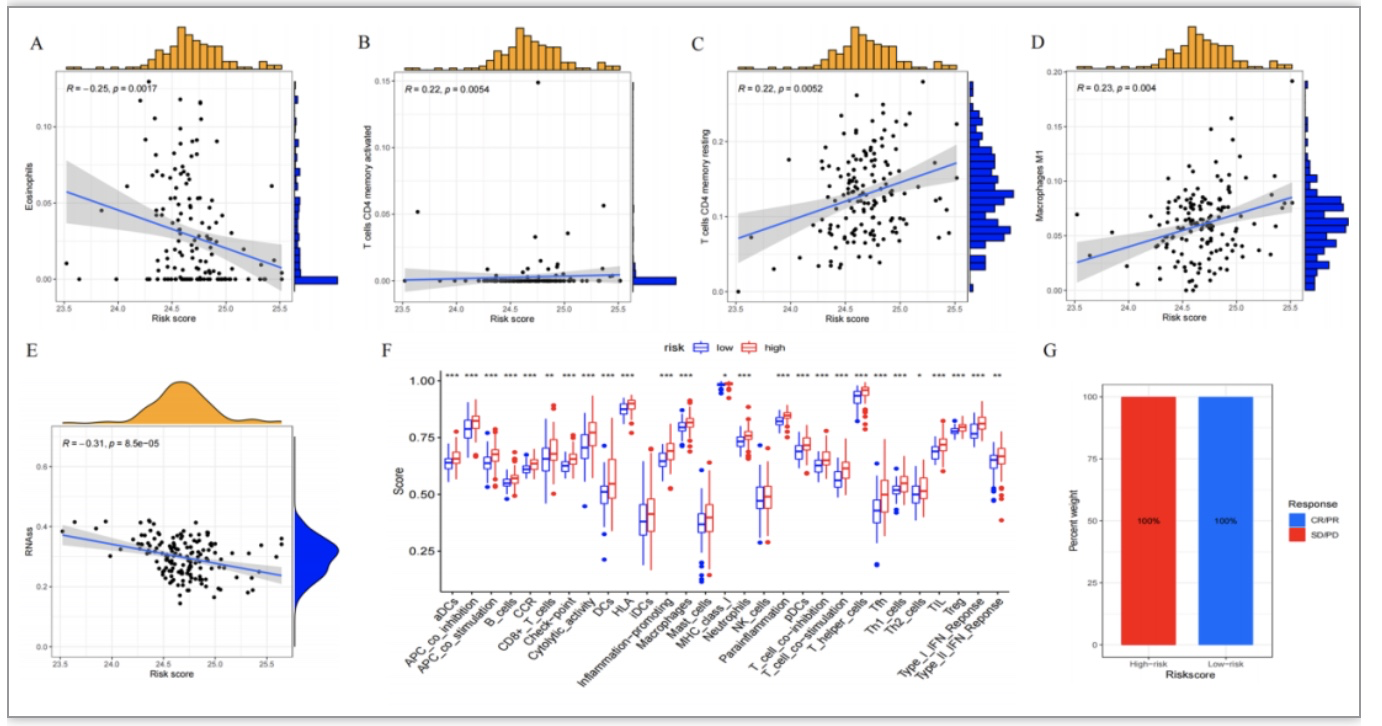
研究者进一步分析了风险评分与肿瘤免疫微环境之间的关系。嗜酸性细胞与风险评分呈显著负相关(R = -0.25,P = 0.0017),而激活的CD4记忆T细胞、静息的CD4记忆T细胞以及M1型巨噬细胞与风险评分表现出显著正相关性(i)(分别为R = 0.22,P = 0.0054;R = 0.22,P = 0.0052;R = 0.23,P = 0.004)(图7A-D)。同时,肿瘤细胞干性评分与风险评分呈显著负相关(R = -0.31, P = 8.5e-05)(图. 7E)。所有的免疫相关功能和免疫细胞丰度在高风险和低风险组之间都存在显著差异。(图7F)这表明风险评分确实可以反映肿瘤的免疫状态。基于ssGSEA算法,箱线图显示了不同风险组中浸润免疫细胞群体的丰度(图7G)。另外,与低风险组相比,高风险组的TIDE得分显著高,这表明低风险组更可能从免疫疗法中受益(图7H)。此外,研究者从IMVIGOR210获取了免疫治疗队列。根据本风险模型,计算出每个患者的风险评分,并将其划分为低风险和高风险组。生存曲线显示,高风险和低风险组之间的整体生存(OS)差异并不显著。然而,有趣的是,研究者发现对免疫治疗反应良好的患者在低风险组,这与之前的预测一致,即低风险组更可能从免疫疗法中受益(图7G)。
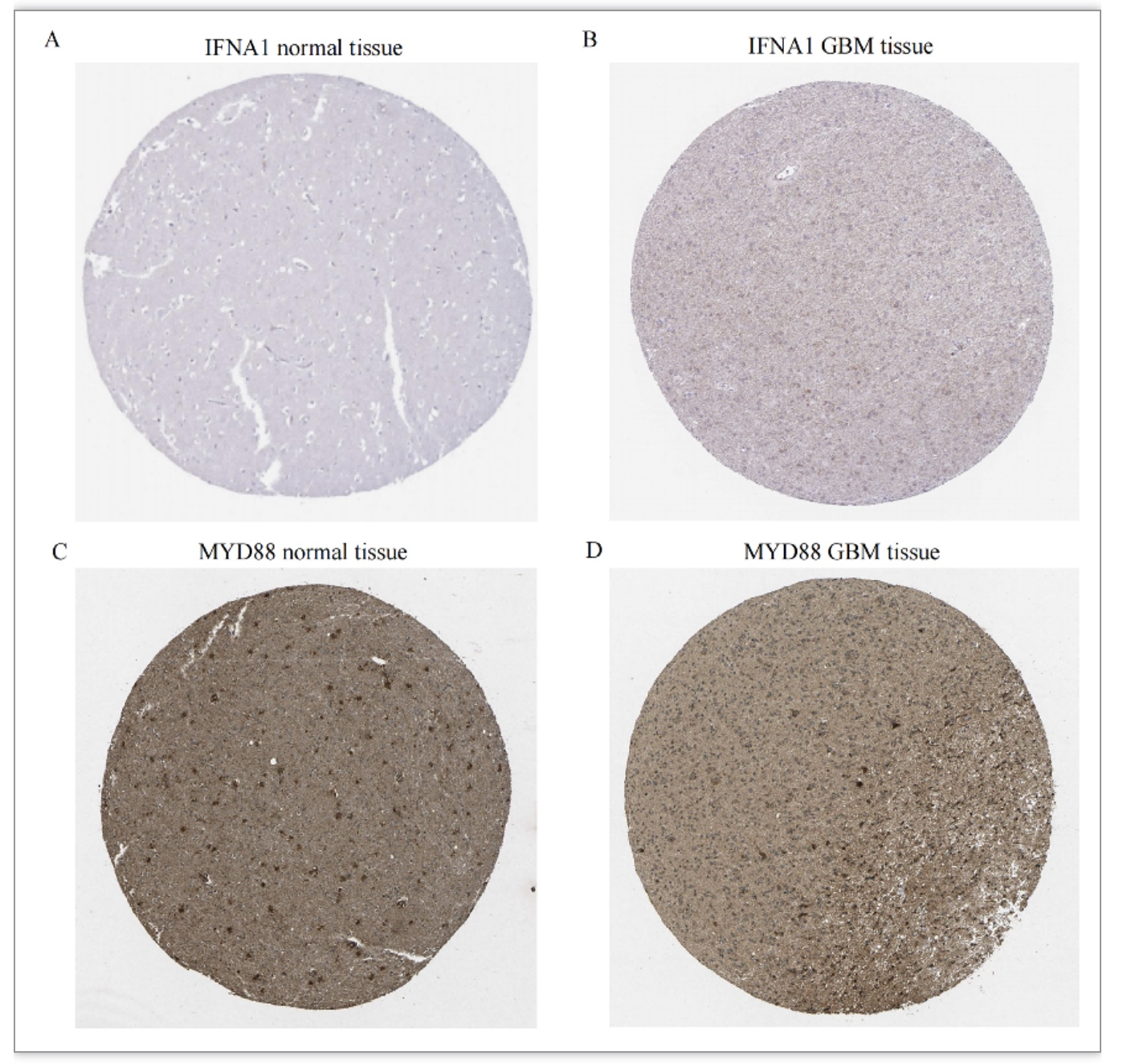
从HPA数据库获取了GBM组织和正常脑组织中ICD特征蛋白的免疫组化染色图像。HPA数据库的免疫组化结果显示,与正常大脑皮层组织相比,GBM肿瘤组织中IFNA1和MYD88的表达显著高于正常组织。这与研究者发现的结果是一致的。在研究者构建的模型中,IFNA1和MYD88都是GBM患者的预后风险因素(图8) 。