
首先,研究者通过氨基酸定点突变在Munc18-1结构域3a的铰链环(loop)上将可能影响Munc18-1功能的氨基酸进行突变。通过非变性胶实验,发现T323A/M324A/R325A突变(TMR)严重破坏Munc13-1 MUN结构域催化的以Munc18-1/Syntaxin-1起始的SNARE复合物组装。这种抑制作用是否由于突变增强了Munc18-1与Syntaxin-1亲和力而引起?研究者通过GST pull-down实验揭示TMR突变未改变Munc18-1与Syntaxin-1的相互作用。接下来,研究者将Munc18-1/Syntaxin-1和Synaptobrevin-2蛋白分别重组到脂质体膜上,观察结构域3a上突变对脂质体膜融合的影响。在Munc13-1催化下, Munc18-1/Syntaxin-1与Synaptobrevin-2及SNAP-25组装SNARE复合物组装,介导脂质体融合,但是TMR突变导致脂质体融合失败。这些结果说明Munc18-1结构域3a铰链环上氨基酸(T323、M324、R325)对Munc18-1/Syntaxin-1转化到SNARE复合物过程十分重要。
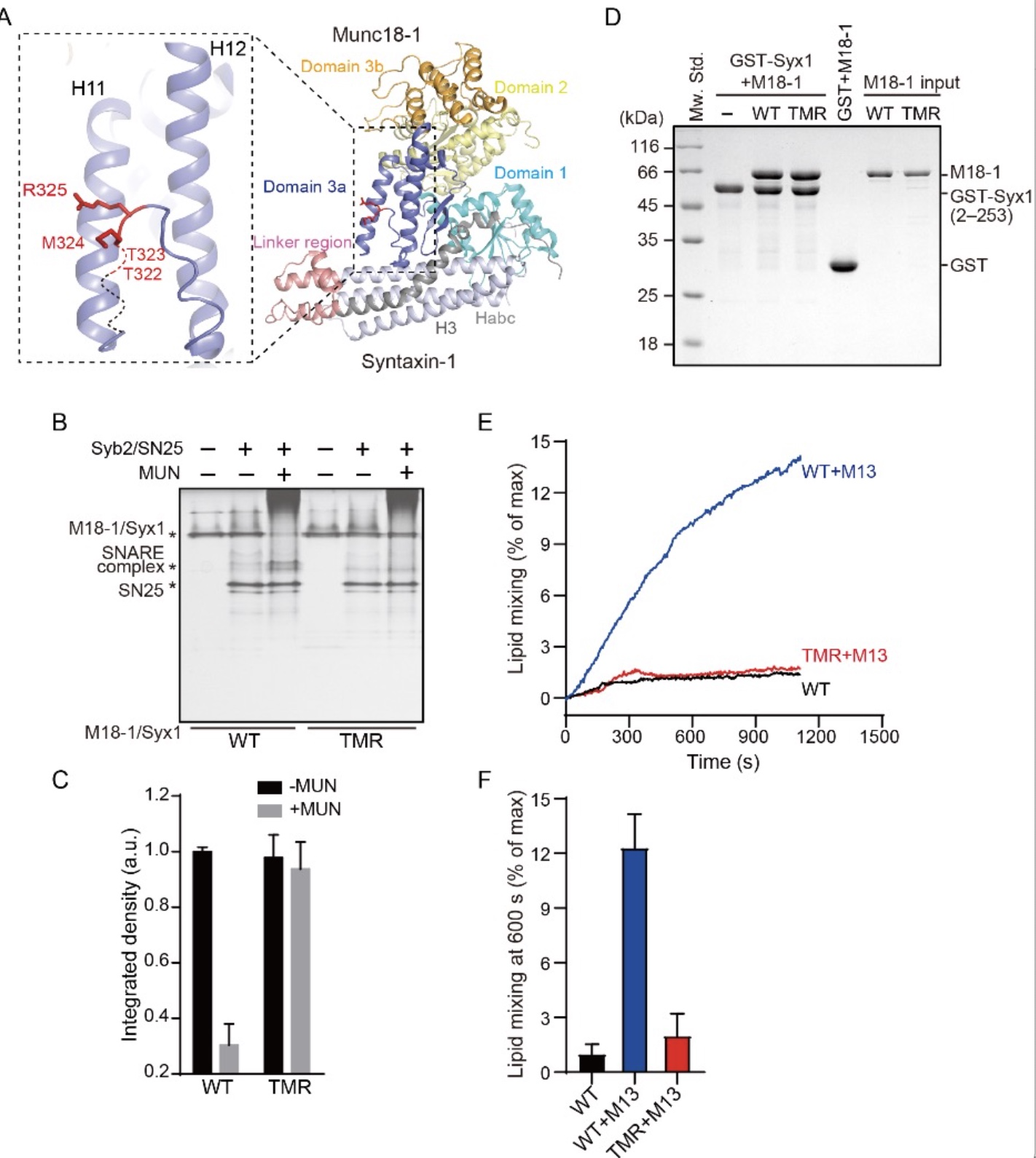
图1. Munc18-1结构域3a上功能关键氨基酸筛选
接下来,研究人员在培养的小鼠大脑皮层神经元中通过RNA干扰技术敲低内源表达的Munc18-1,并回补表达野生型(WT)及突变体Munc18-1,利用全细胞膜片钳技术,记录结构域3a上突变对神经递质分泌的影响。发现结构域3a上突变严重破坏神经元的自发微小抑制性突触后电流(mini IPSC)和动作电位诱发的抑制性突触后电流(evoked IPSC)。这些结果表明结构域3a上突变对突触囊泡分泌十分重要。进一步实验发现该突变既不影响Munc18-1在神经元细胞中的表达及转运,也不影响突触形成。因此,研究人员推测是否这些氨基酸在突触囊泡启动过程中发挥作用?于是,研究人员通过高渗蔗糖触发已成熟的抑制性突触囊泡释放(surcose IPSC),通过统计其电荷转移量,来揭示突变对神经元可释放囊泡库大小的影响。结果发现突变不能够恢复Munc18-1敲低引起的可释放囊泡库的减小。这些结果说明结构域3a上氨基酸突变通过破坏突触囊泡启动过程从而抑制囊泡分泌。由于囊泡启动过程的本质是SNARE复合物组装,因此体内和体外结果是一致的。
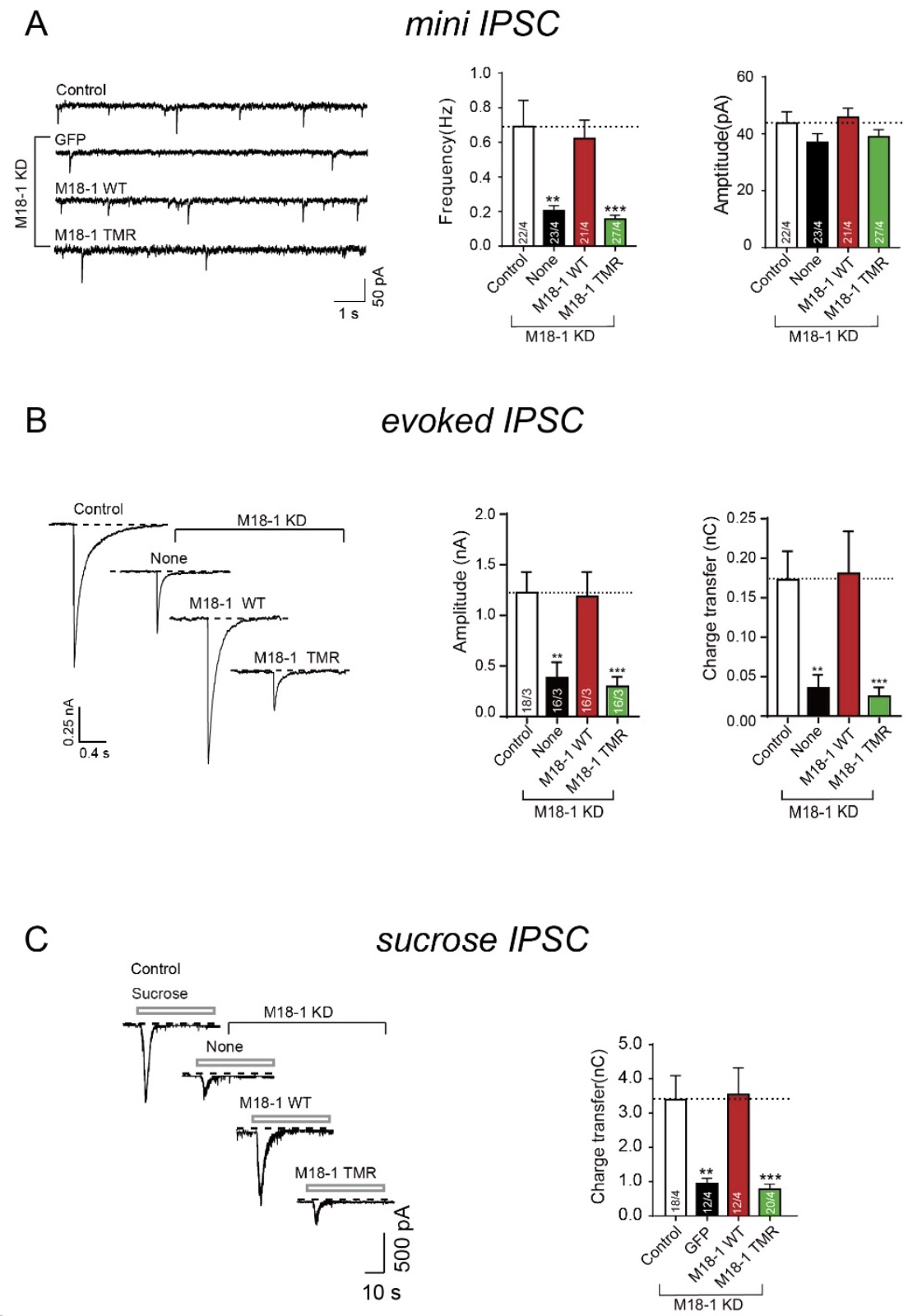
图2. Munc18-1关键氨基酸突变严重破坏神经突触囊泡分泌
体外和体内实验结果共同表明结构域3a对Munc18-1/Syntaxin-1转化到SNARE复合物过程及囊泡成熟过程至关重要。但是其具体作用机制是什么?之前研究表明Munc18-1结构域3a构象伸展后能够识别并结合Synaptobrevin-2和Syntaxin-1的SNARE基序区(SNARE motif),将其在空间上拉近(称为模板功能),从而促进SNARE复合物组装,破坏两种相互作用都将抑制SNARE复合物组装。从结构上分析氨基酸T323、M324、R325位于伸展的铰链环底部,是否这些氨基酸参与结合Synaptobrevin-2?因此,研究者检测了单独Munc18-1与Synaptobrevin-2的相互作用。在脂质体上重组SNARE蛋白,Munc18-1通过与Syntaxin-1及Synaptobrevin-2相互作用,从而促进SNARE复合物组装,进而促进脂质体融合,结果发现突变体与野生型Munc18-1都可以促进脂质体融合。接下来,研究者通过GST pull-down实验直接监测Munc18-1与Synaptobrevin-2之间的相互作用,发现突变不影响Munc18-1与Synaptobrevin-2结合。这些实验结果共同表明当Munc18-1单独存在时,TMR突变不影响Munc18-1结构域3a构象倾向于伸展的趋势及Munc18-1与Synaptobrevin-2的结合。
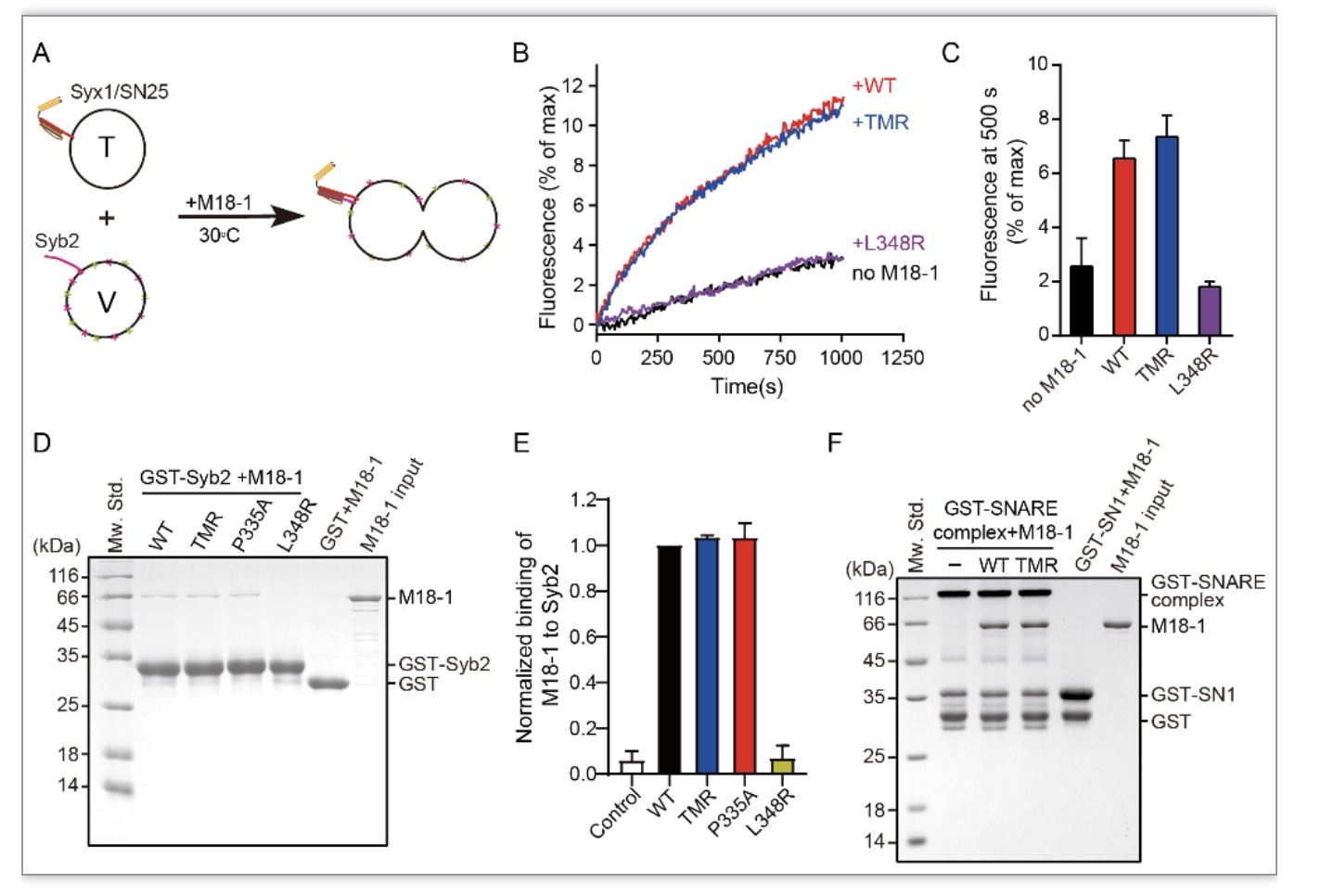
图3. Munc18-1关键氨基酸突变不影响单独Munc18-1与Synaptobrevin-2结合
Munc18-1与Syntaxin-1紧密结合形成复合物,此时Munc18-1结构域3a的铰链环卷曲向上,Syntaxin-1铰链区形成闭合构象,从而使Syntaxin-1无法参与SNARE复合物组装。在Munc18-1/Syntaxin-1向SNARE复合物转化中,Munc18-1结构域3a构象由“卷曲”到“伸展”,Syntaxin-1铰链区由“闭合”到“打开”,两种构象变化对转化能否正常进行至关重要。单分子荧光共振能量转移(smFRET)实验表明TMR突变不影响Munc13-1 MUN结构域诱导Syntaxin-1铰链区构象发生变化。Munc18-1/Syntaxin-1中,Munc18-1结构域3a处于卷曲构象,抑制结构域3a与Synaptobrevin-2结合,Munc13-1 MUN结构域诱导Syntaxin-1铰链区打开,结构域3a随之伸展,Synaptobrevin-2结合到结构域3a上。因此,研究者通过GST pull-down实验监测Synaptobrevin-2能否结合到Munc18-1/Syntaxin-1复合物上来揭示TMR突变是否影响结构域3a构象变化。结果发现MUN结构域存在条件下,TMR突变导致Synaptobrevin-2无法与Munc18-1/Syntaxin-1相互作用,由于TMR突变不影响单独Munc18-1与Synaptobrevin-2结合,因此可以得出结论,Syntaxin-1铰链区打开之后,TMR突变导致卷曲的结构域3a不能伸展,从而不能正常发挥模板功能。
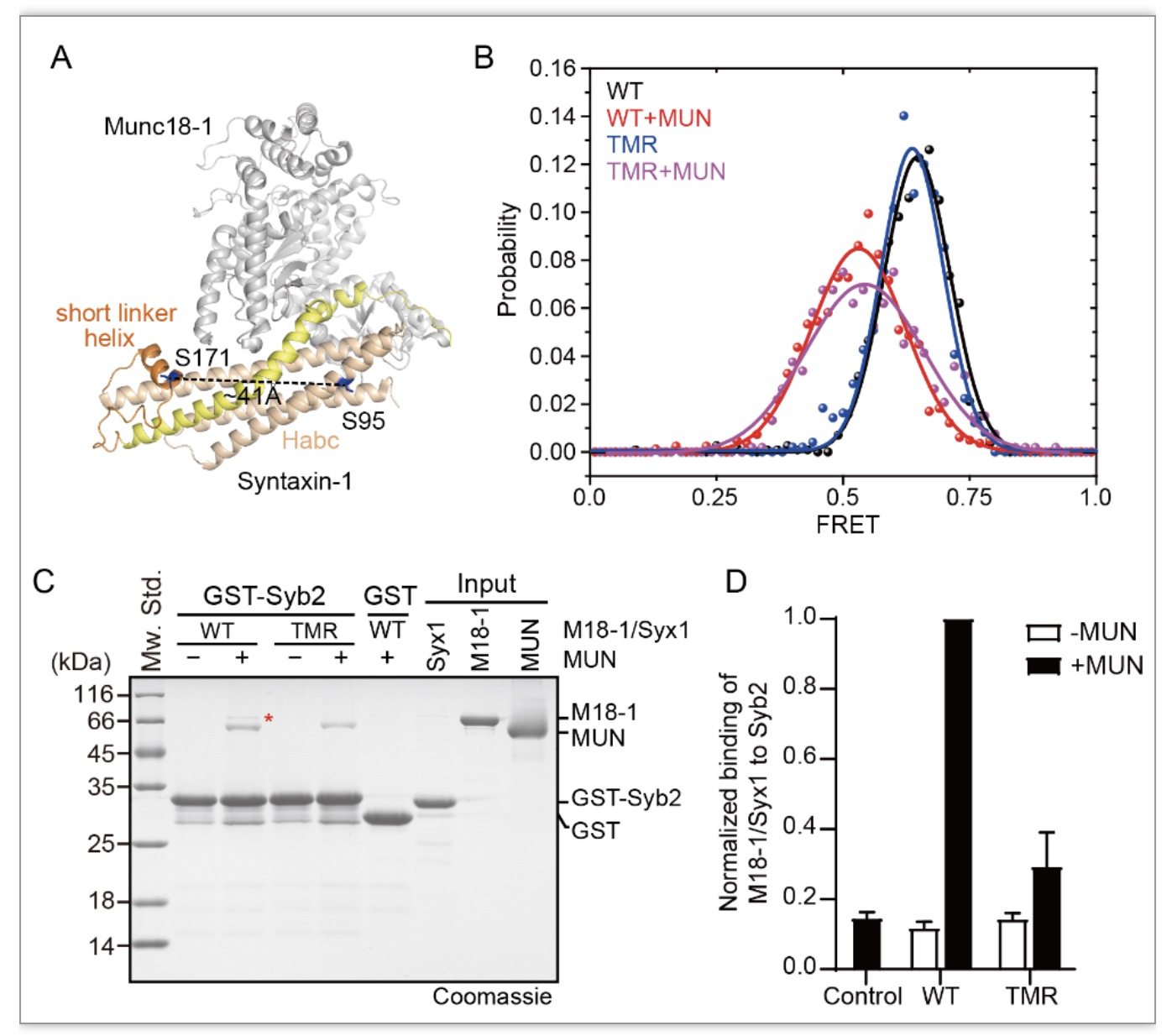
图4. Munc18-1关键氨基酸突变选择性抑制Munc18-1结构域3a构象伸展

