类风湿性关节炎(rheumatoid arthritis ,RA)是世界性顽疾,但衰老是否为影响疾病发病机制的危险因素和机制尚不清楚。目前的研究表明,多种因素,包括衰老、吸烟史、免疫原性和遗传多态性,可能与RA的发病机制及其难治性问题有关。疾病进展时间为5-10年,残疾率为43-48%,有效预防或延缓RA的发作将对RA患者大有裨益。因此,与RA发病相关的基因的鉴定和表征可能为未来RA预防性治疗方法的发展奠定坚实的理论基础。老龄化目前是人类不可避免的过程,与年龄相关的慢性病是全球发病率、住院、医疗保健费用和死亡率的主要原因。因此,有必要研究老年人RA高发病率的原因,以建立RA的预防策略。

研究表明,在衰老过程中,DNA片段在血液中积累和循环,成为循环游离DNA(cfDNA)。值得注意的是,DNA片段化也被认为是许多疾病的生物标志物。事实上,Aicardi-Goutières综合征和系统性红斑狼疮(SLE)都有一个共同的表型特征,即不能正常清除自身DNA或自身RNA片段,导致免疫系统异常激活。有趣的是,经改善病情的抗风湿药物(DMARDs)治疗的RA患者的血浆DNA碎片显著减少,这表明DNA碎片可能与RA的发病机制相关。基于中老年患者RA发病率增加可能是由于DNA片段的年龄相关积累的假设,澳门科技大学黄锦伟教授带领的研究团队最新研究发现:老年人及老年RA患者中TREX1基因表达较年輕人或健康老年人明显降低,且血清cfDNA升高,这提示机体cfDNA水平与年龄以及RA的发病机制相关联。研究团队巧妙地设计了一系列关节炎动物实验予以验证:(1)建立SD大鼠佐剂性关节炎(AIA)模型,证实了模型大鼠中的TREX1转录水平较正常大鼠明显降低,血清cfDNA浓度较正常大鼠明显升高,与临床RA患者的检测结果相一致;(2)采用CRISPR/Cas9技术,首次构建了TREX1条件性基因敲除的SD大鼠,发现DNA碎片可以诱导以及加重TREX1基因敲除SD大鼠的关节炎病情;(3)通过腺相关病毒介导TREX1基因高表达的SD大鼠AIA模型,发现其关节炎程度较非TREX1基因高表达大鼠明显减轻,说明促进TREX1基因高表达能够显著减轻关节炎的病理程度。因此,结合上述临床和转基因动物实验研究结果,研究团队证实TREX1基因的低表达和cfDNA积累可促进中老年RA疾病的进展。为进一步明确RA在老年人中的高发病率,团队着眼于衰老开展了深入研究,发现AIA模型中TREX1低水平与大鼠中类似衰老相关分泌表型(SASP)的细胞状态有关,且由于c-Jun和c-Fos失调后影响异二聚体转录因子AP-1生成, 继而降低了TREX1表达。
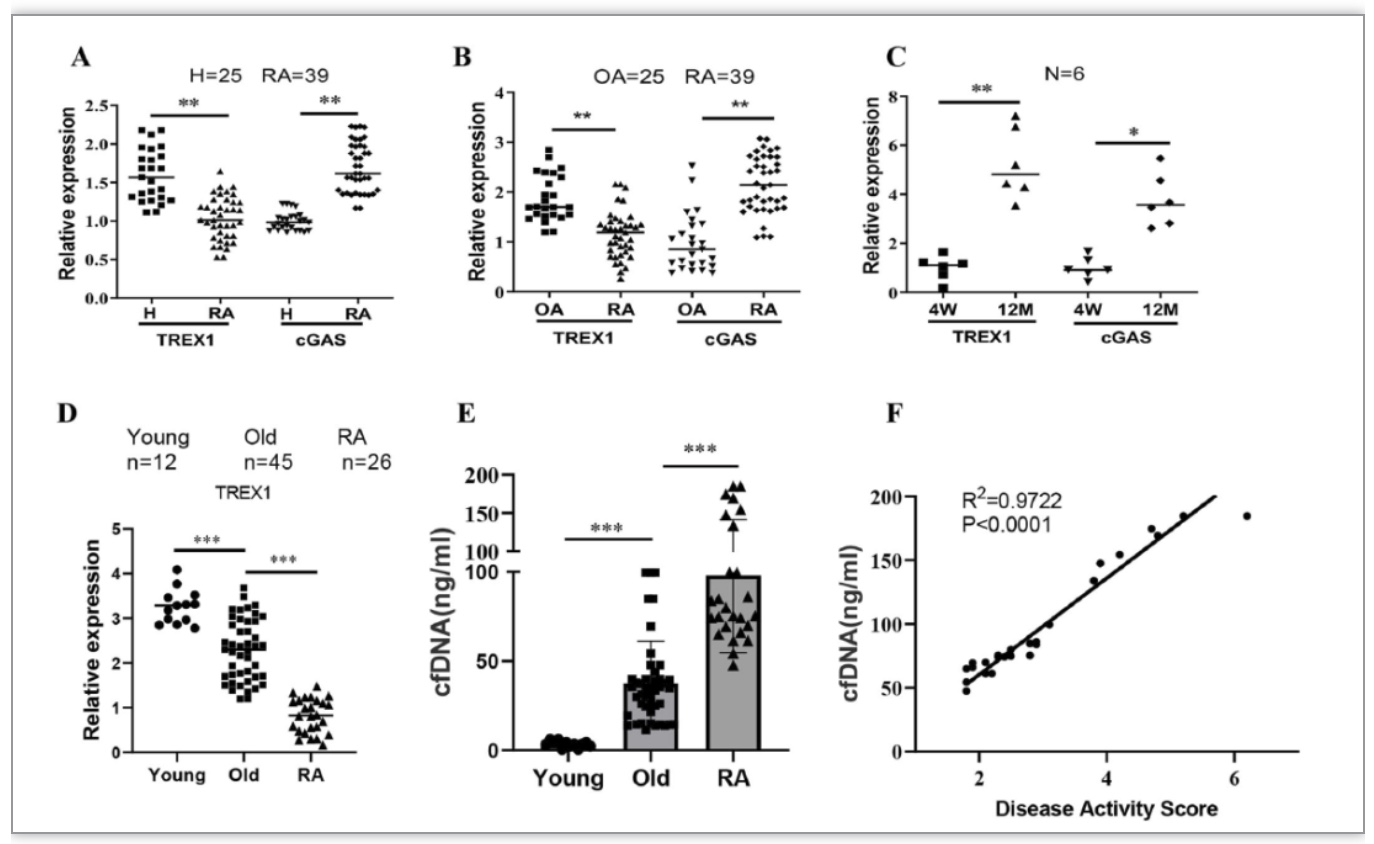
图1. TREX1和cGAS在类风湿性关节炎(RA)患者和用DNA片段刺激的RA FLSs中产生炎性细胞因子中的表达的相关性

图2. TREX1Cre大鼠AIA模型中尾静脉注射DNA片段对炎症的影响。
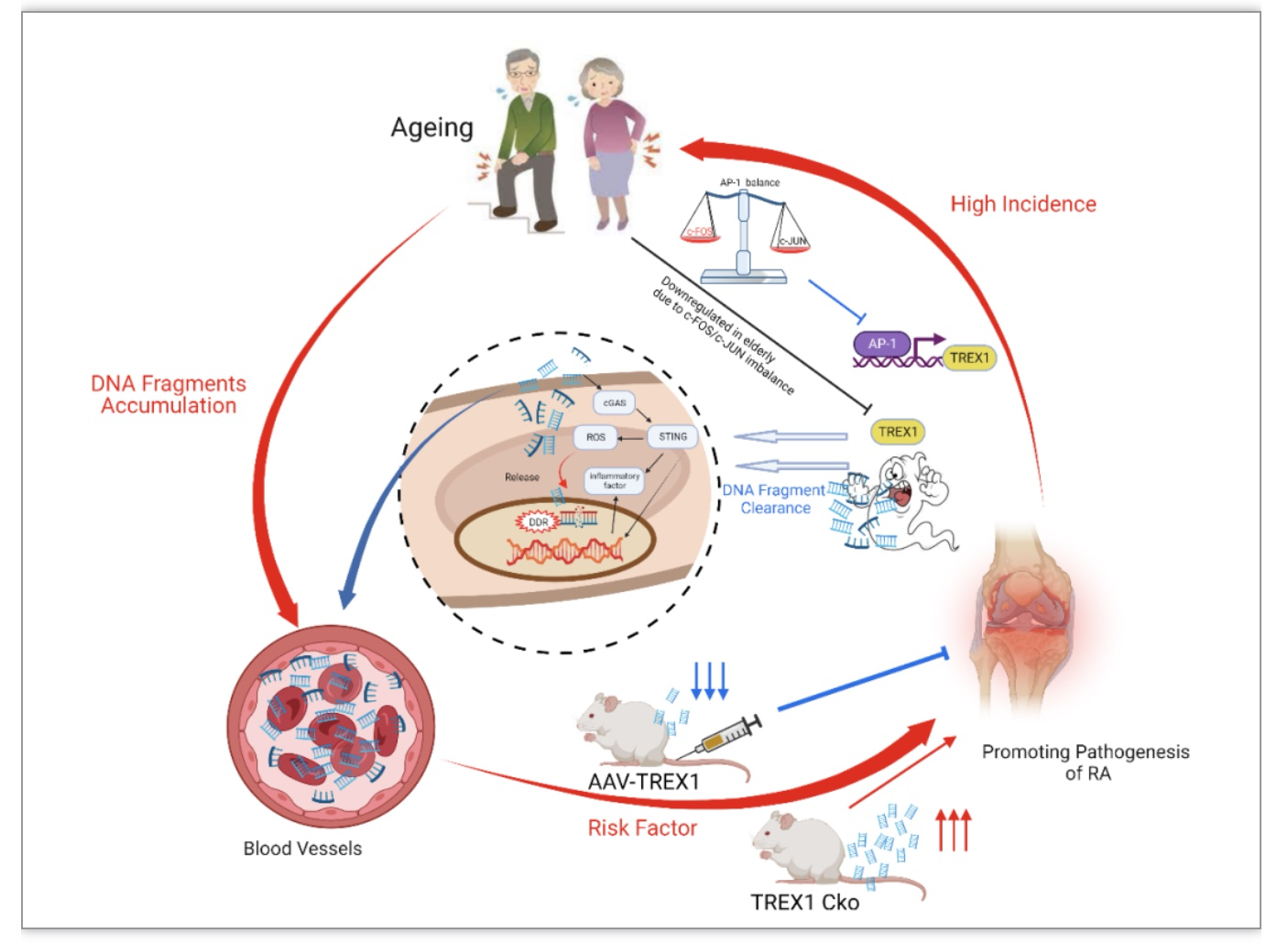
图3. 模式图

