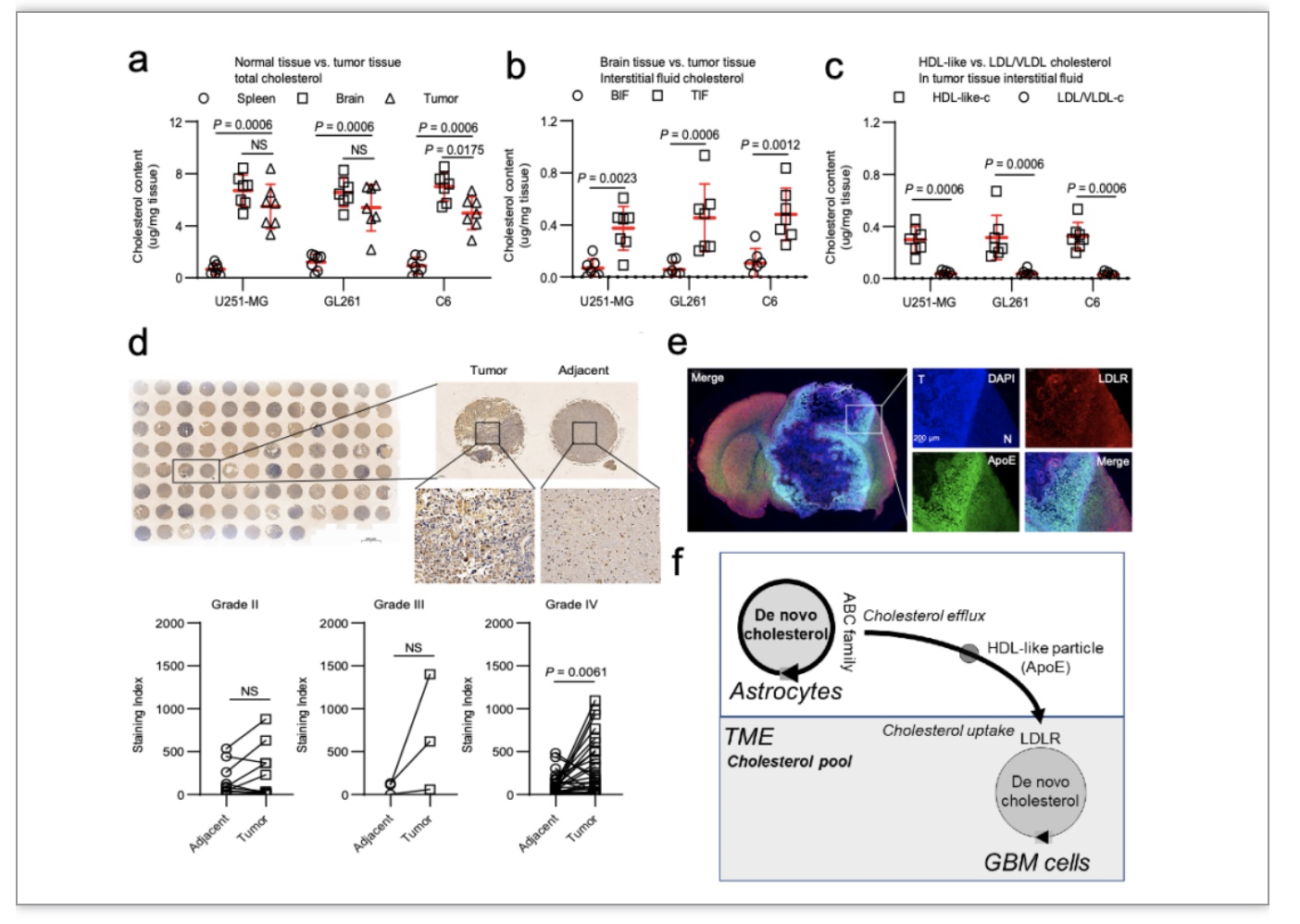
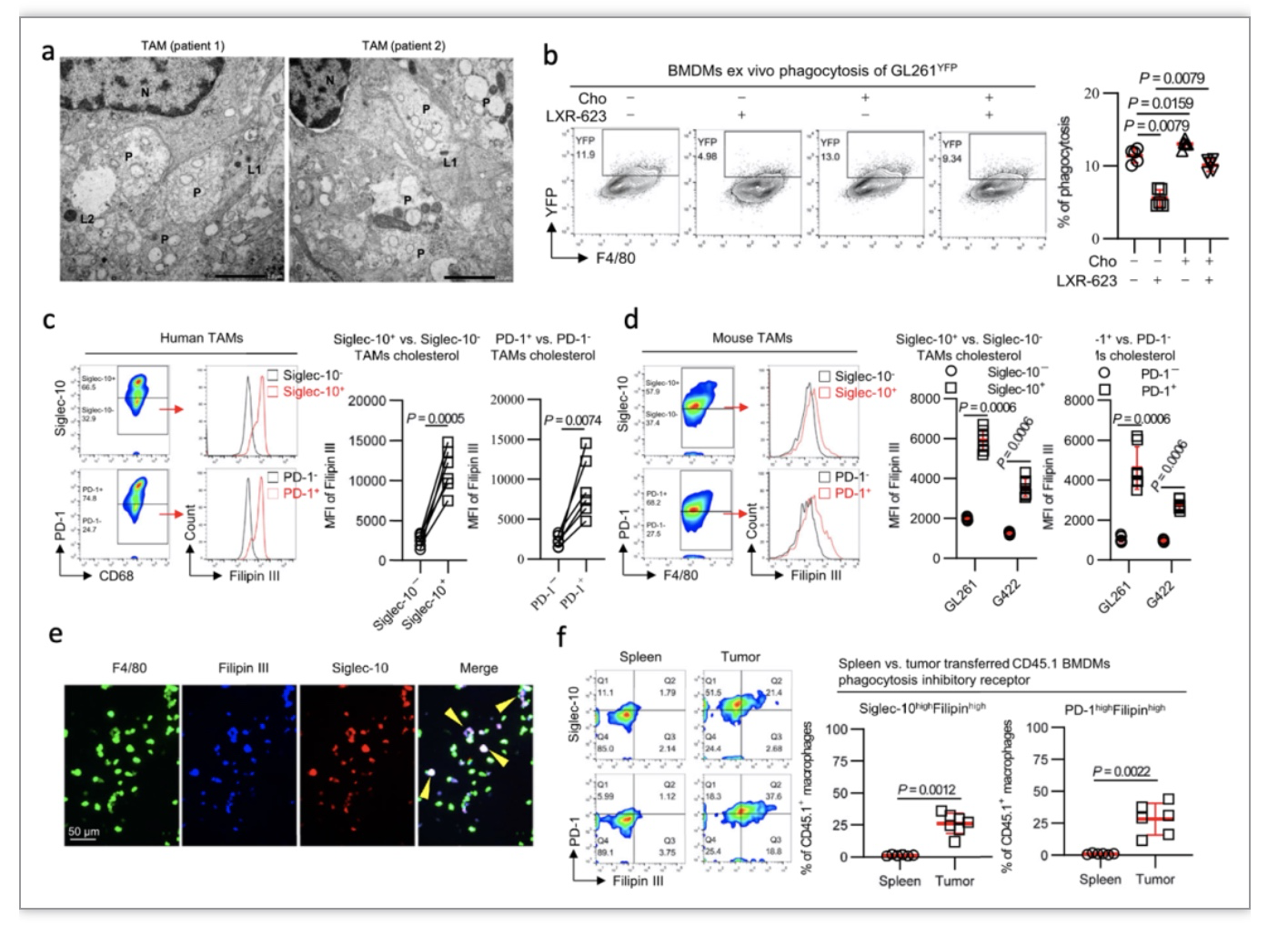
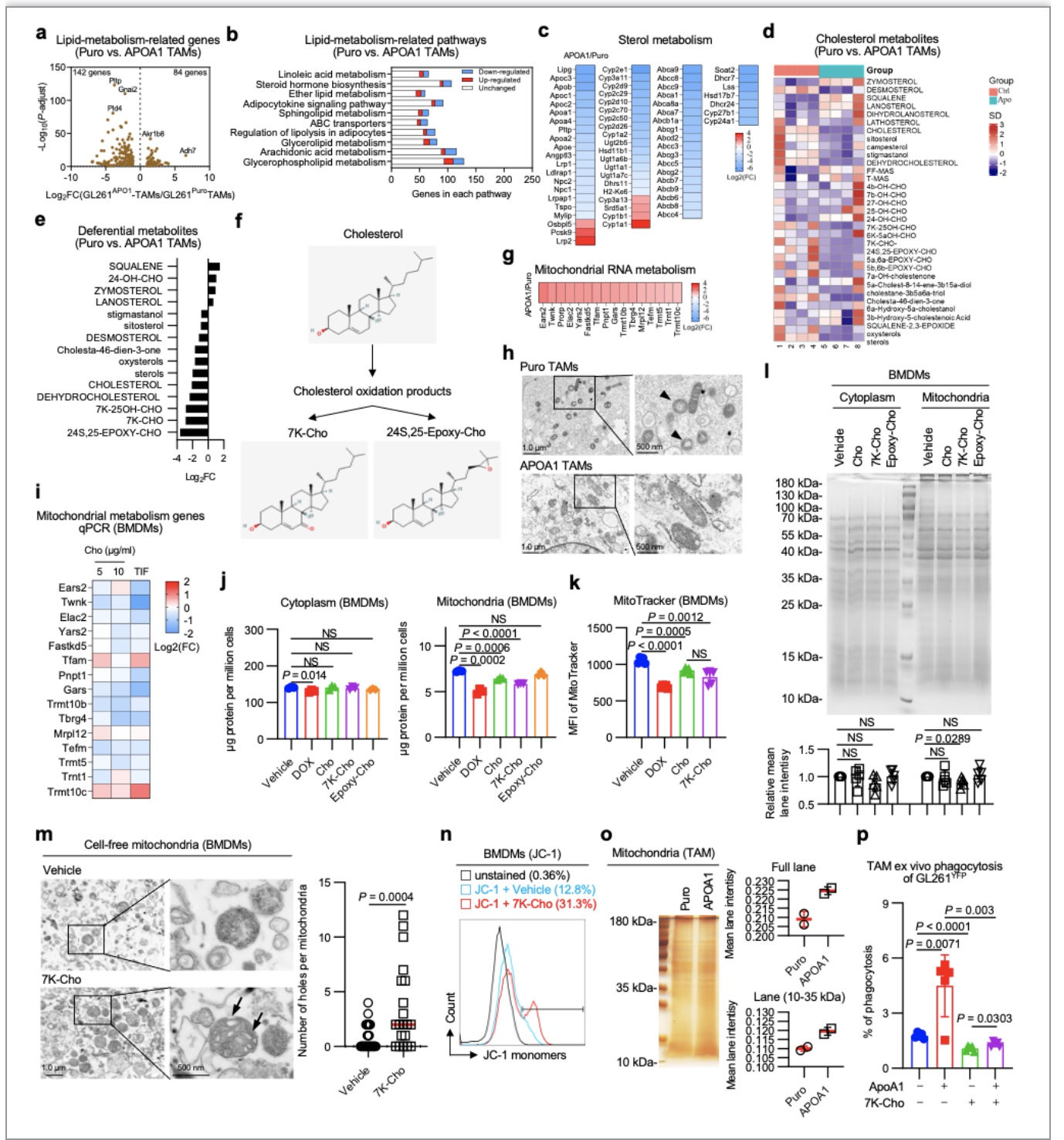
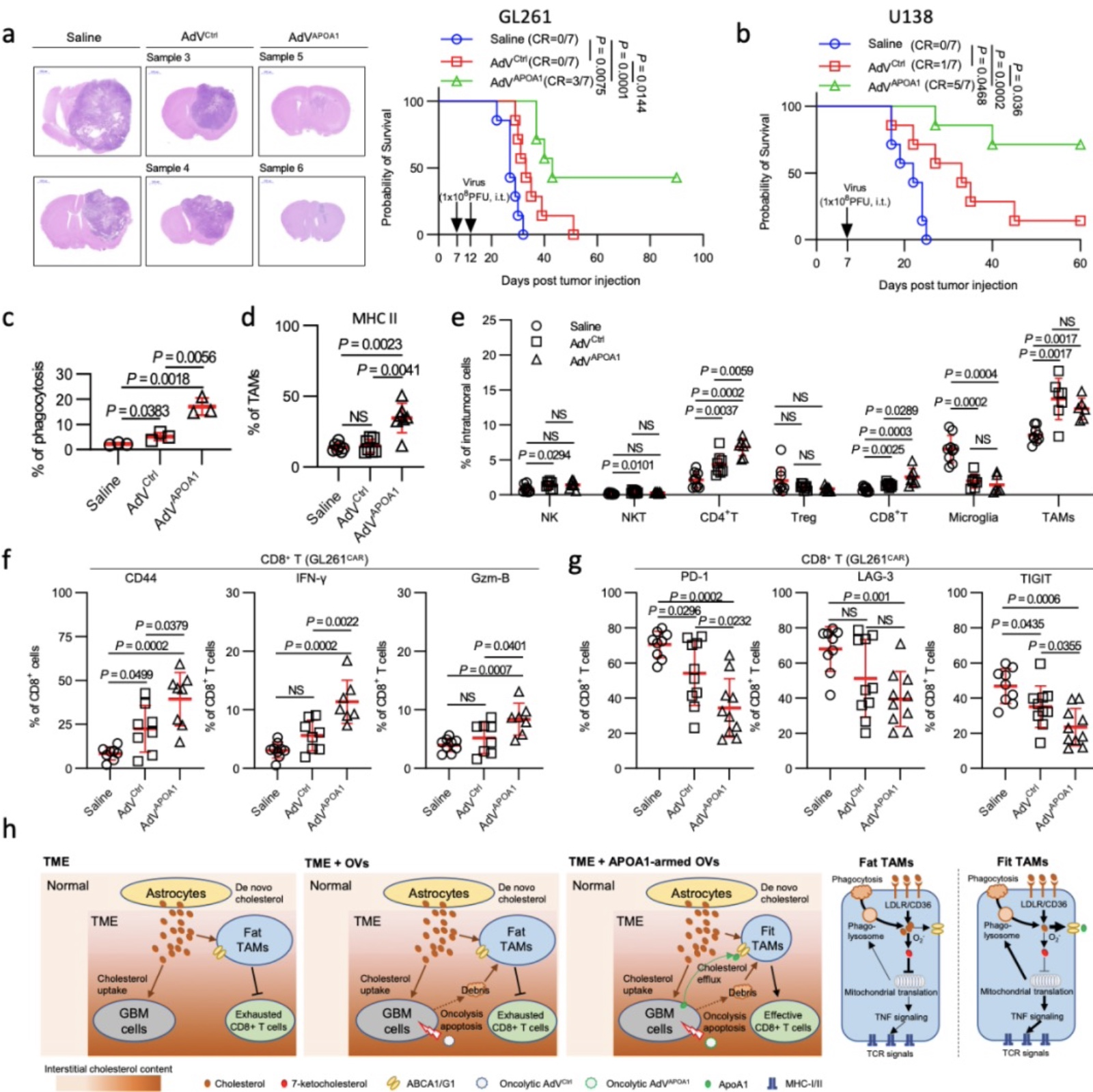
胶质母细胞瘤(GBM)是恶性程度最高的颅内肿瘤。目前,GBM的治疗方式以手术切除为主,放疗、化疗等综合治疗为辅。然而,接受这些传统治疗的患 者的中位生存期不足两年并且伴有高度复发风险[1]。近年来,免疫疗法在外周肿瘤中所取得的突破性进展,以及中枢神经系统(CNS)淋巴循环通道的发现,使得 GBM的免疫治疗成为可能[2]。然而,已有的研究表明即便 GBM 可以被免疫系统 识别,其多方位的免疫耐受或逃逸机制使得免疫疗法难以在 CNS 内激发持久的抗肿瘤免疫反应[3,4]。因此,阐明胶质瘤的免疫耐受机制对于寻找有效的治疗方案至 关重要。与外周肿瘤不同的是,大脑在解剖上的差异使其形成了独特的肿瘤代谢(包括脂质、糖、氨基酸)特征。特别是 GBM 细胞所需要的胆固醇主要依赖外源性摄取胆固醇而非自身从头合成。越来越多的研究表明,肿瘤微环境胆固醇代谢紊乱在肿瘤恶性进展、免疫逃逸和治疗抵抗中发挥重要作用[5,6]。因此,阐明 GBM 微环境胆固醇代谢紊乱的机制,并对其进行精准修正,有可能突破 GBM 免疫治疗耐受的困境。