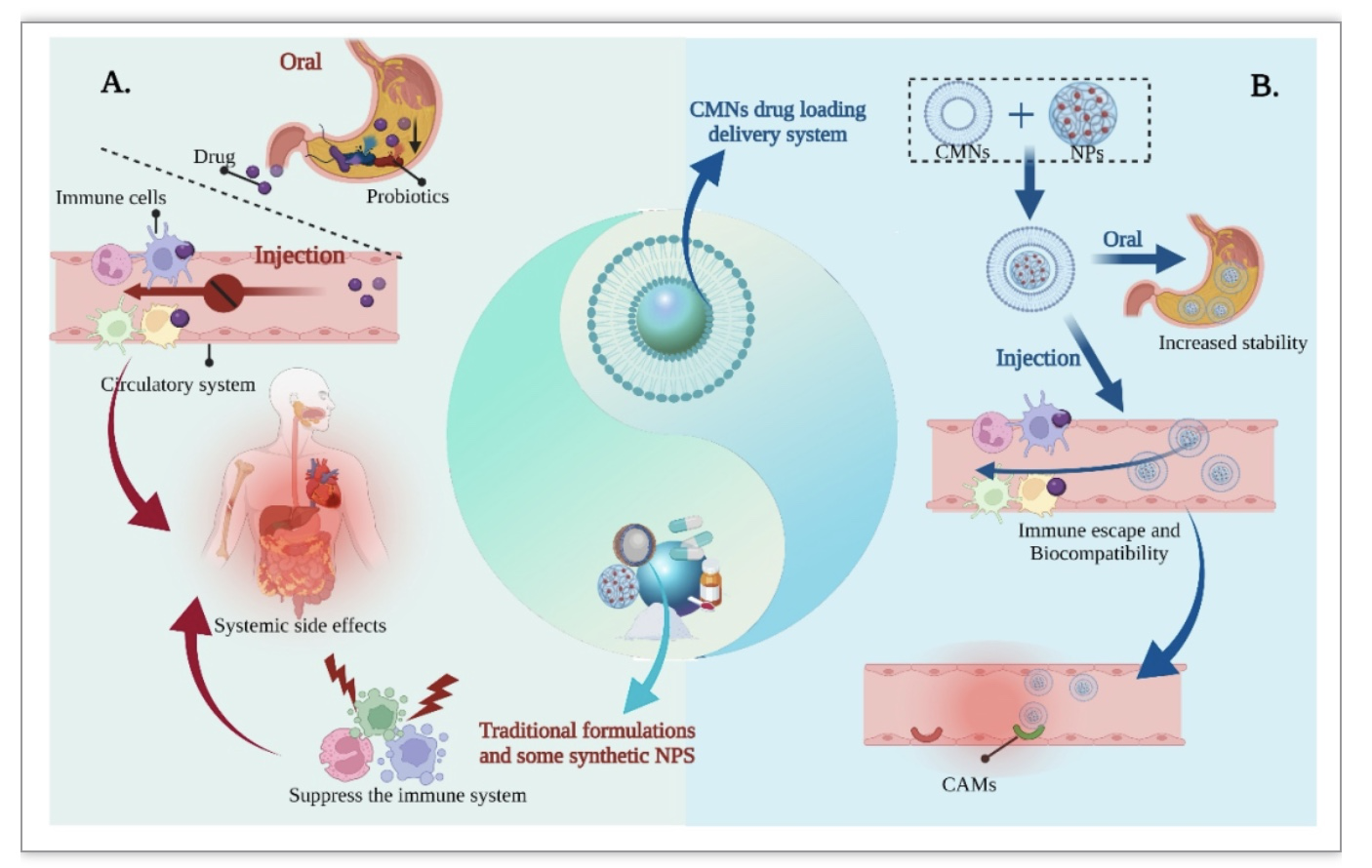
炎症性肠病(IBD)是一种严重的慢性肠道疾病[1]。全球发病率还在持续上升 [2]。由于现有治疗药包括传统治疗药物、生物制剂和新型小分子药物由于到达肠道的药物蓄积力量十分有限,以及较低的靶向性,会被运输到人体全身组织,会无差别的与所有人体细胞中的高亲和力的胞浆内受体结合,在不同程度上造成全身副作用[3,4]。因此开发既有较好的药代动力学特征,又可以避免副作用的纳米药物靶向递送系统是IBD治疗的更有效的策略 [5,6]。纳米材料 (NPs) 的引入使药物的生物学特性发生了革命性的变化,其已成为载药递送系统的研究热点,例如,聚合物、二氧化硅、壳聚糖、脂质体以及细胞膜等,已经被成功地开发并应用于IBD的治疗。和一些合成NPs相比,细胞膜纳米材料(CMNs,红细胞膜(RBCMs)、中性粒细胞膜(NEMs)、巨噬细胞膜(MMs)、细菌和酵母膜(YMs)等),因其特异的炎症靶向性、免疫逃避和具有母细胞的生物功能,其已经成为了靶向IBD治疗的理想的递送材料(图1)[7,8]。
图2. CMNs和合成NPs联合使用起到多靶点治疗IBD的效果。
通过注射给药的方式去治疗IBD,其在及时给药和提高药物生物利用度方面具有优势,并在很大程度上降低了药物的肝脏首过代谢。然而,可以注射的且安全性高的合成材料几乎很少,与合成递送材料相比,哺乳动物细胞来源的细胞膜是注射用药物输送更安全的递送系统。细胞膜作为细胞与细胞通信系统的一部分,其具有非凡的生物相容性,以及高度的特异靶向性,一些细胞膜甚至具有自身固有的治疗作用。利用细胞膜载药用于注射给药的方法治疗IBD,通过血液循环到达发炎部位,极大的提高了药物的生物利用度,并且减轻了类固醇类和生物制剂类药物的副作用,使抗炎药物可以很好的起到治疗IBD的效果 [9,10]。
RBCMs被广泛用于靶向IBD的治疗其具有显著的药物释放性能,可以在血液中循环长达120天,并且减少了免疫系统对其的清除作用,很适合于包裹各种生物活性化合 [11]。当其用作药物载体时,它的膜可以在适当的条件下打开并重新密封,容易分离,并且比其他涂层具有更长的寿命,因此,其成为了一种良好的药物载体 [12]。
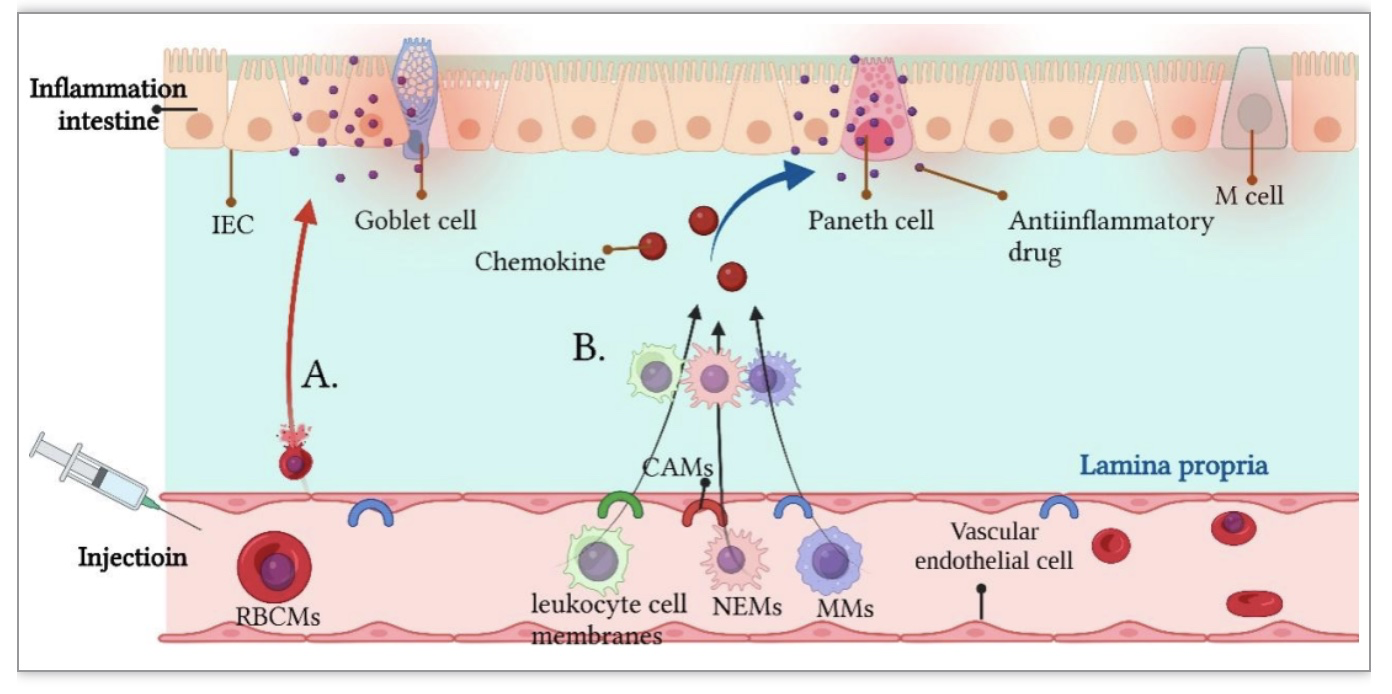
免疫细胞是指参与免疫应答或与免疫应答相关的细胞,包括巨噬细胞、中性粒细胞、淋巴细胞和树突状细胞等。在IBD期间,趋化因子可以在免疫应答过程中诱导免疫细胞进入炎症部位,所以被激活的免疫细胞能够归巢到炎症部位。另外其可以与炎症内皮细胞上的细胞黏附分子结合定向靶向炎症部位。因此采用被激活的免疫细胞膜(MMs、NEMs、SKL等)包裹NPs或药物的递送系统继承了母细胞膜固有的生物功能,不仅起到保护和延长循环时间的作用,而且为药物以及NPs披上一层伪装的外膜,可以规避免疫系统的捕获。同时,可以定向潜入受损的肠道上皮,起到对IBD高效和精确的治疗。因此细胞膜成为了注射给药的一种理想的对于局部炎症靶向的功能材料(图3)[13–15]。
图3. 注射CMNs递送系统IBD靶向治疗的示意图
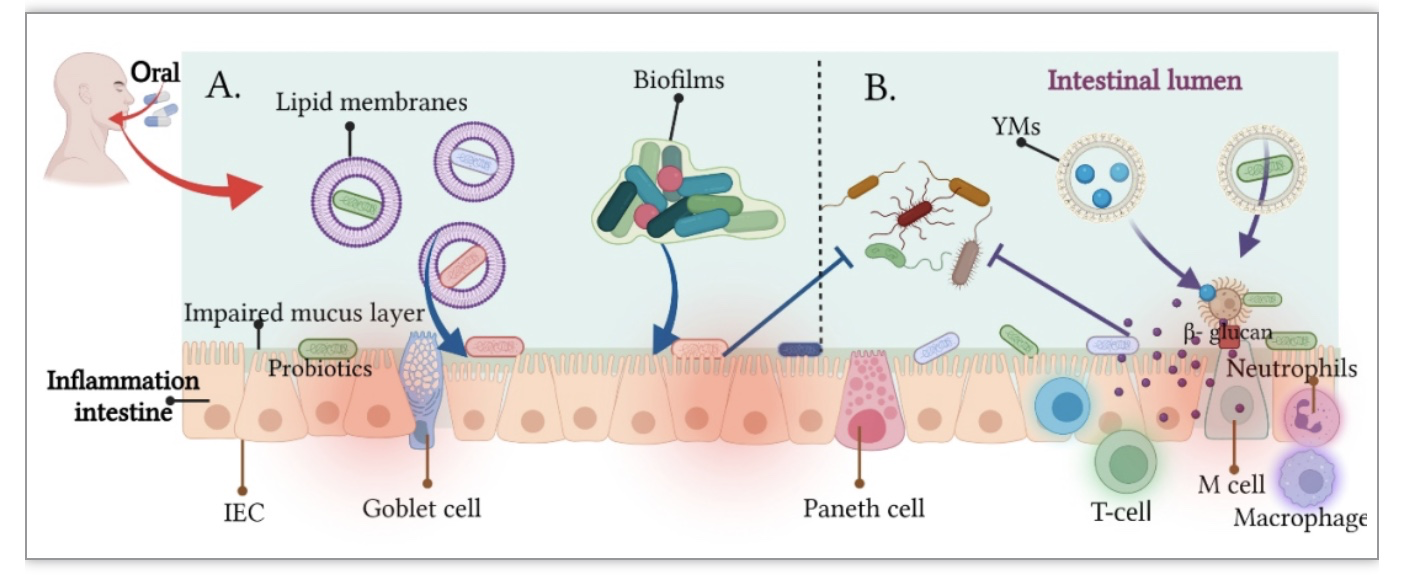
口服类固醇类和免疫抑制剂等蛋白质衍生的肠炎药物以及益生菌主要挑战在于胃肠道的极端环境的影响,造成药物和益生菌输送效率和利用度降低,而且传统的和合成材料的递送方式靶向性和很难避免药物带来的全身副作用,同时可能由于外层涂层材料可以防止益生菌与肠道粘膜直接接触,因此在肠道内的定植和增殖有限,导致益生菌保留时间短,不足以充分发挥作用。因此,我们通过包裹独特的细胞膜的方式口服给药来规避胃肠环境带来的影响以及起到靶向肠道炎症的部位,提高益生菌和药物有效性和安全性 [5,16]。
YMs递送系统由于其坚硬的肽聚糖层,可以保护药物不被胃酸胃液所破坏 [17]。另外,YMs表面的β-1,3-D-葡聚糖可以被顶端膜受体 Dectin-1识别,其在巨噬细胞和肠道上皮微褶皱细胞上具有高度表达,因此其具有对巨噬细胞和肠上皮细胞的靶向性。以及由于YPs空腔的多孔微球结构,游离和负载的药物NPs尚未被完全包埋,从而YPs还可以负载不同功能的NPs。同时,结肠中的肠道微生物群的代谢产物β葡聚糖酶可以降解YPs中的主要成分β-1,3-D-葡聚糖,它们可以被消化为短链脂肪酸和二氧化碳,从而释放负载的药物 [18,19]。另外,也有研究通过免疫细胞膜作为保护性材料用于口服药物的递送材料,可以很好的起到靶向治疗的效果,为免疫细胞膜口服给药在IBD治疗中的应用奠定了基础(图4)[20]。
图4. 口服CMNs递送系统对IBD靶向治疗示意图
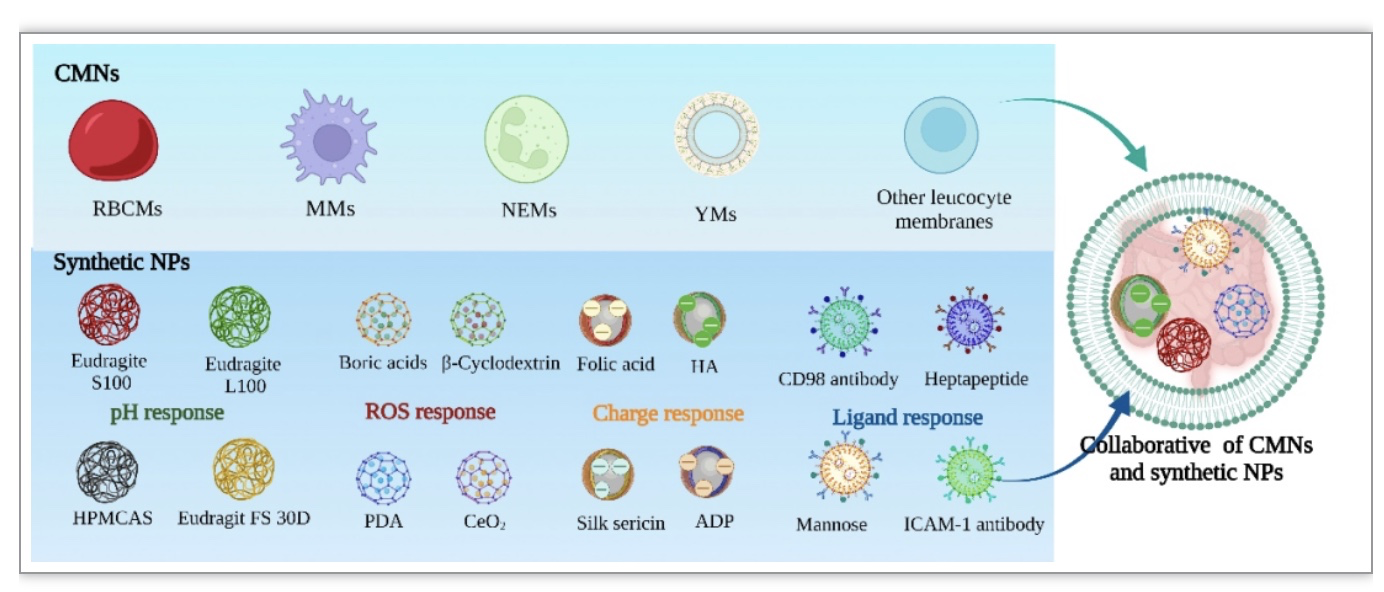
目前CMNs选择性靶向肠道疾病给药系统已经取得了重大进展,但是,仅设计单一的细胞膜包裹给药策略由于缺乏灵活性或在遇到复杂恶劣的肠道微环境时失去选择性,对IBD的治疗存在局限性[13–15,21]。因此,结合合成NPs的多功能性和细胞膜的独特功能,两者协同作用,弥补各自不足,这种递送方式才是目前靶向IBD治疗的主流趋势(图5)[22,23]。
图5. 合成材料递送系统靶向IBD部位的示意图。(A)由HPMCAS、Eudragite等pH响应材料包裹的NPs具有了抵抗胃酸的破坏,从而靶向肠道部位;(B)本身带负电荷的NPs靶向炎症结肠上皮上聚集的正电荷蛋白等;(C)由硼酸酯、环糊精、Ce-MOF和AKT等ROS响应材料包裹的NPs具有靶向炎症肠道异常过多的ROS部位;(D)甘露糖、HA、CD98抗体、KPV、叶酸、半乳糖基化壳聚糖、七肽和Fab’等配体可以靶向炎症肠上皮细胞和活化巨噬细胞上的甘露糖受体、CD44、CD98、PepT1、FR、MGL、TFR和F4/80等;(E)ICAM-1抗体和sLe等可以黏附在炎症血管上皮细胞上的CAMs。
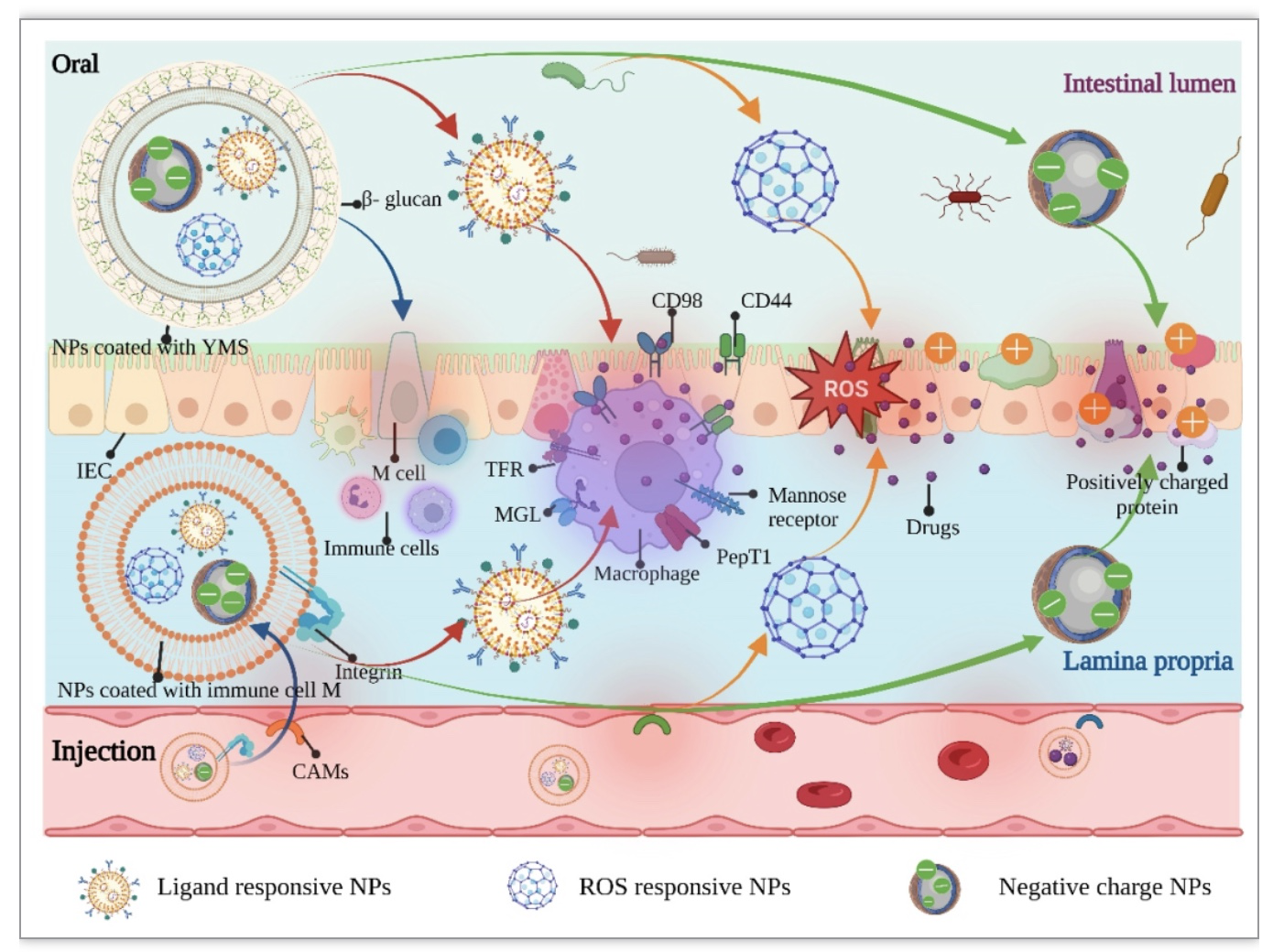
由于目前对于CMNs包裹NPs治疗IBD的靶向递送方案还在初步探索阶段,相关的研究也并未系统化,在这里我们提供一种“分层的程序化”的递送方案,采用CMNs搭载一种或者多种电荷、ROS和配体等响应的NPs的方式,利用细胞膜自身独特的免疫逃避特性、保护性以及炎症的趋化性,从而靶向肠道炎症部位,之后裂解释放被包裹的NPs,最后募集在炎症肠道聚集的正电荷蛋白和ROS部位。实现了多范围的精确靶向性,极大的提高了药物的利用率。这种策略有望克服单一机制给药的局限性,为今后对于靶向IBD治疗的研究提供了选择性使用NPs的思路,也是未来对IBD的靶向递送治疗的发展趋势(图6)。
图6. CMNs包裹合成响应NPs的“分层程序化”递送系统靶向治疗IBD的示意图。
通过结合合成NPs的多功能性和细胞膜的独特功能,两者协同治疗IBD的递送方式正在崭露头角,为IBD未来的治疗提供了最理想的给药方案。另外,也需要发现和研发更多的响应材料、特异性配体以及更多的CMAs的递送系统,为局部靶向IBD治疗提供更多的选择方案。与此同时,NPs还需要进行可靠和标准化的制备,合理的简化处方设计和制备工艺,使其可以规模化生产以及踏入临床治疗。我们相信,CMNs靶向递送系统会推动纳米医学和IBD治疗的进一步发展,也为胃肠道癌症和病毒感染等胃肠道疾病提供借鉴。