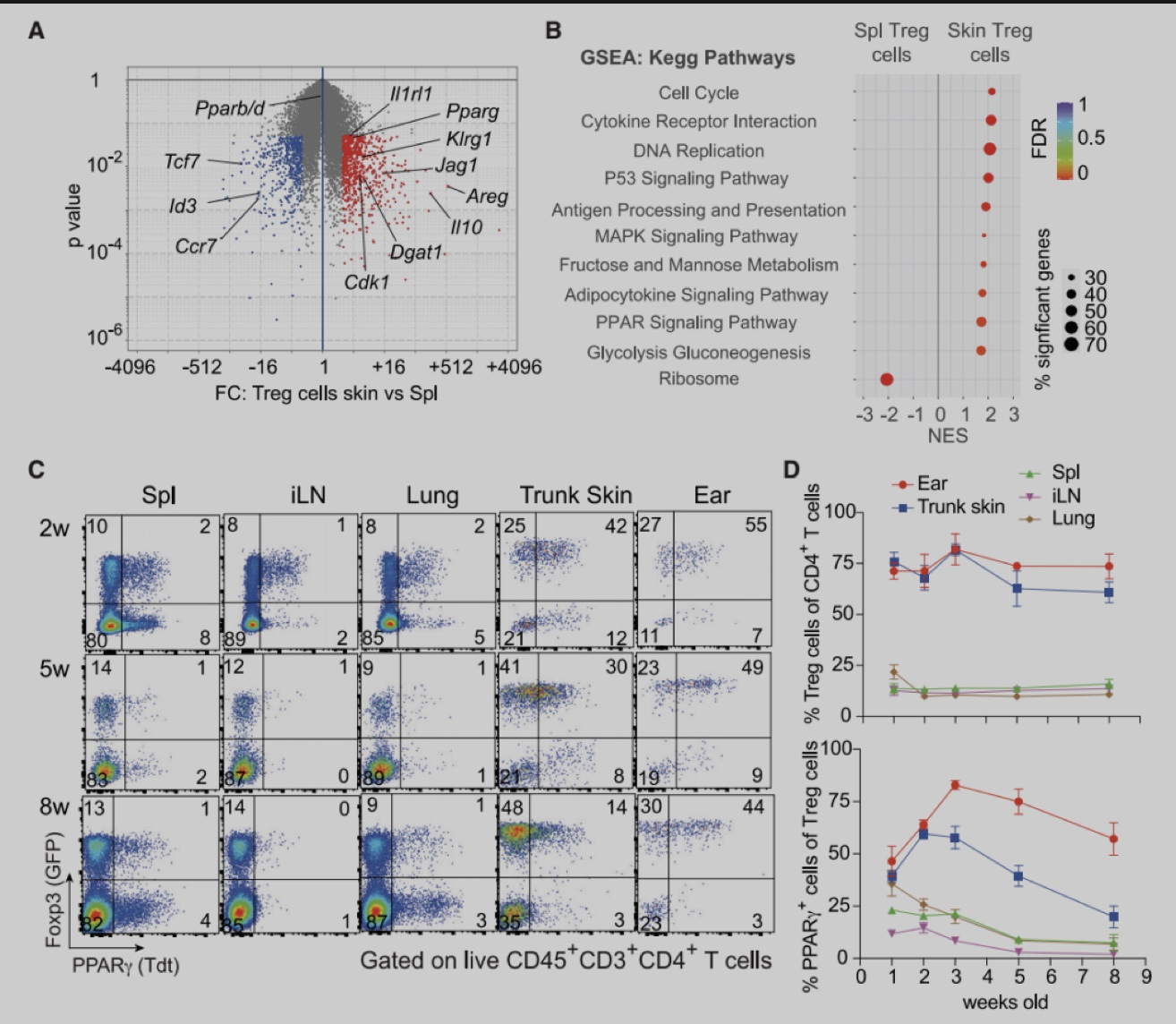
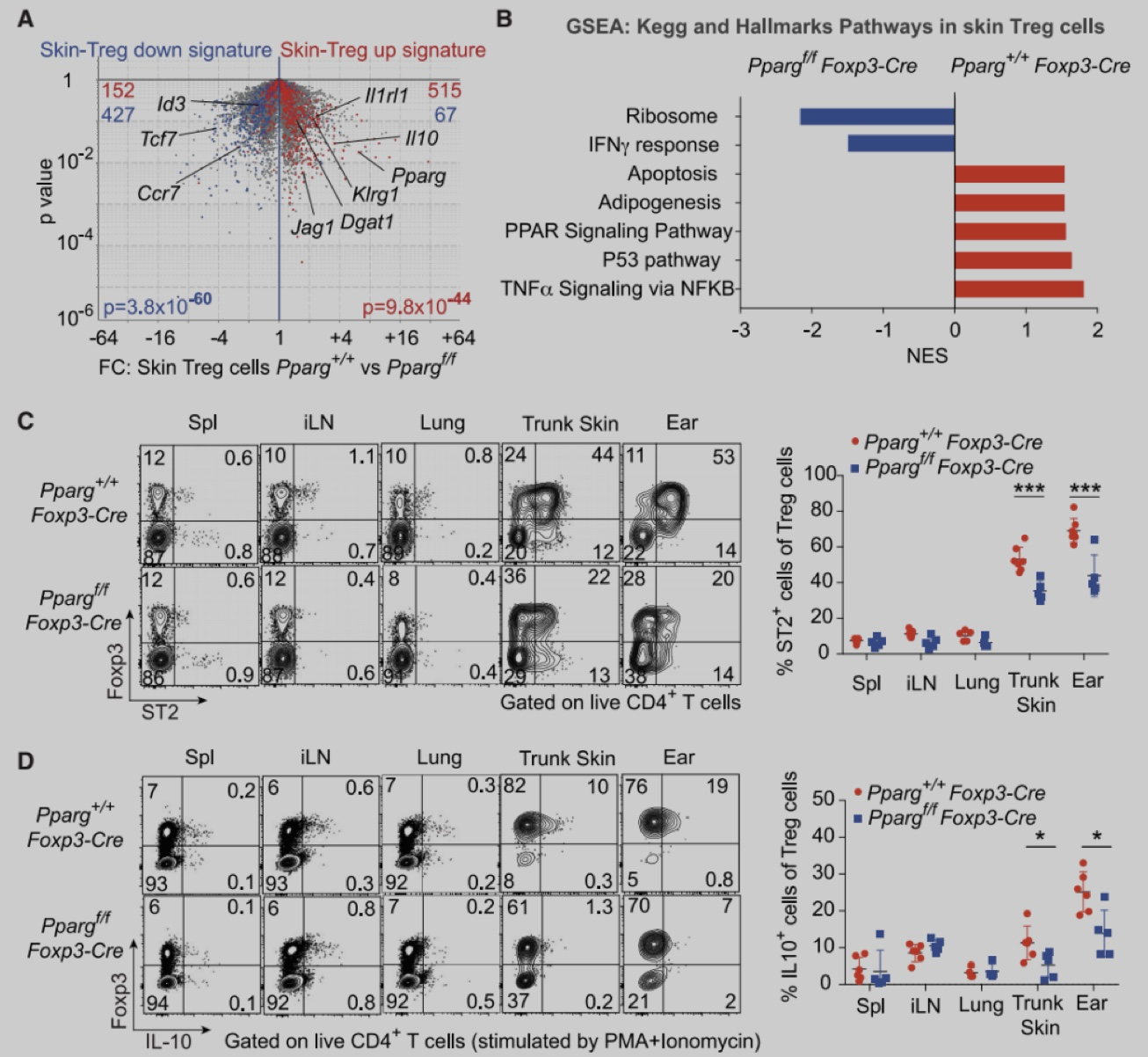
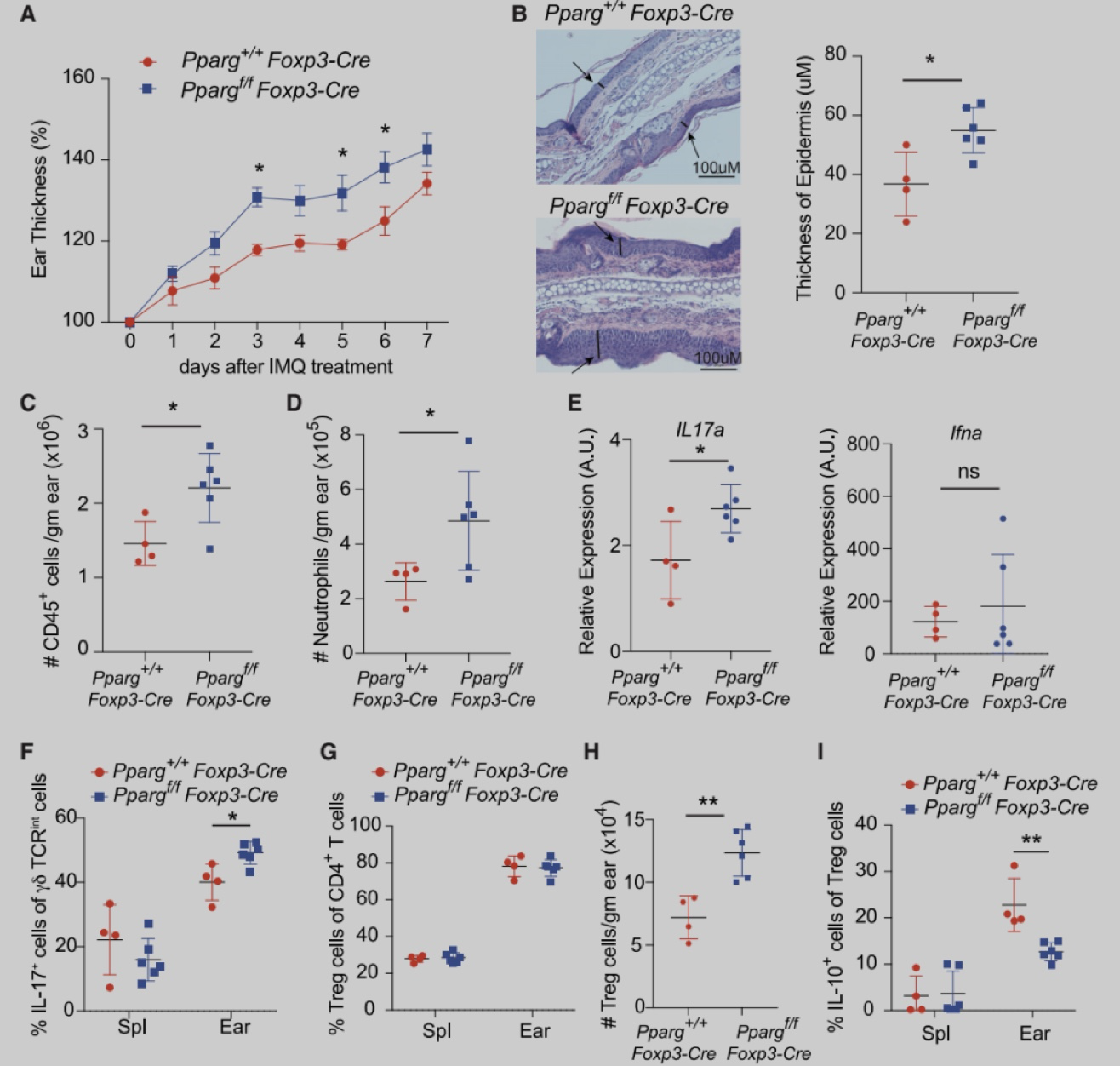
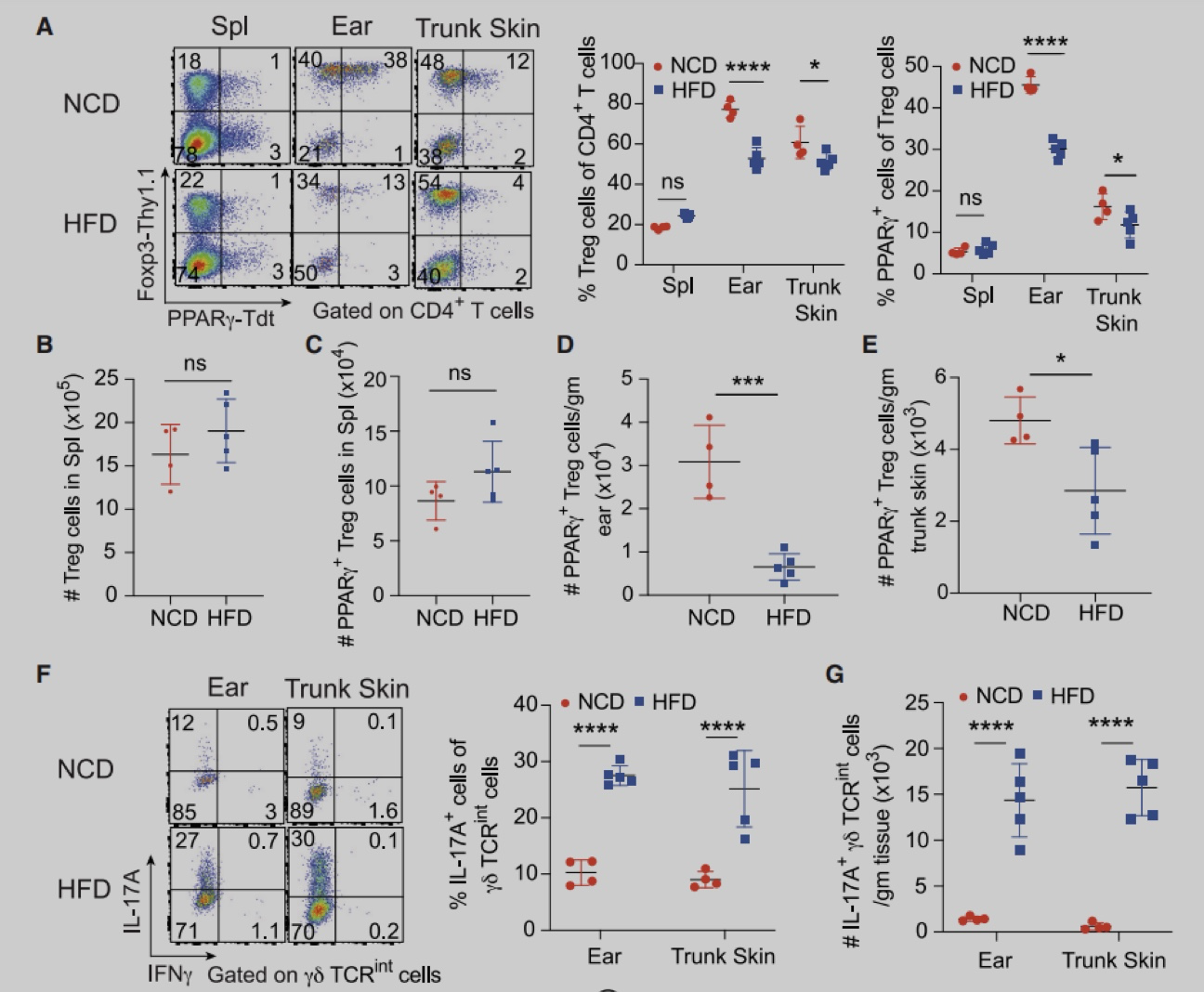
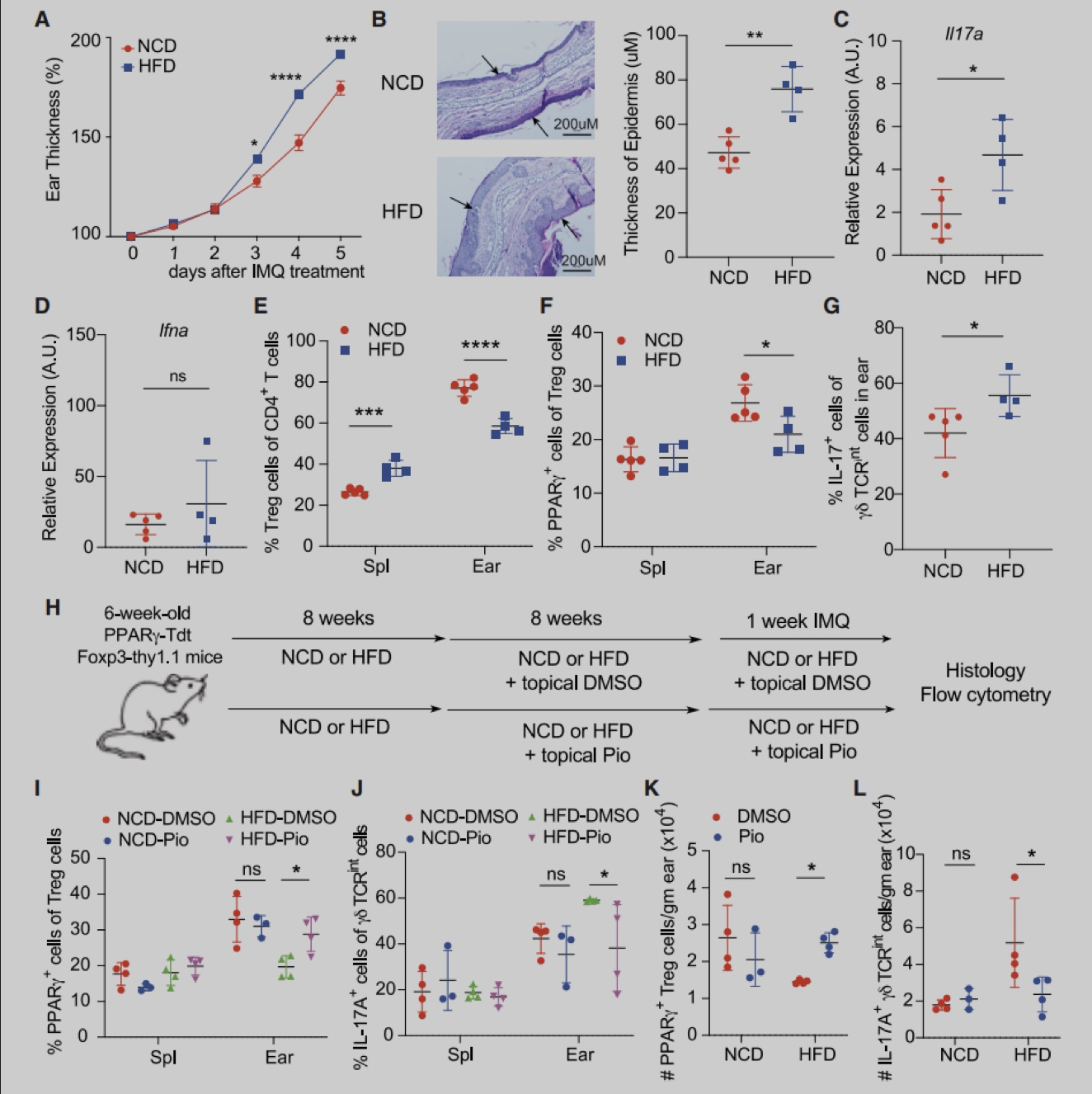
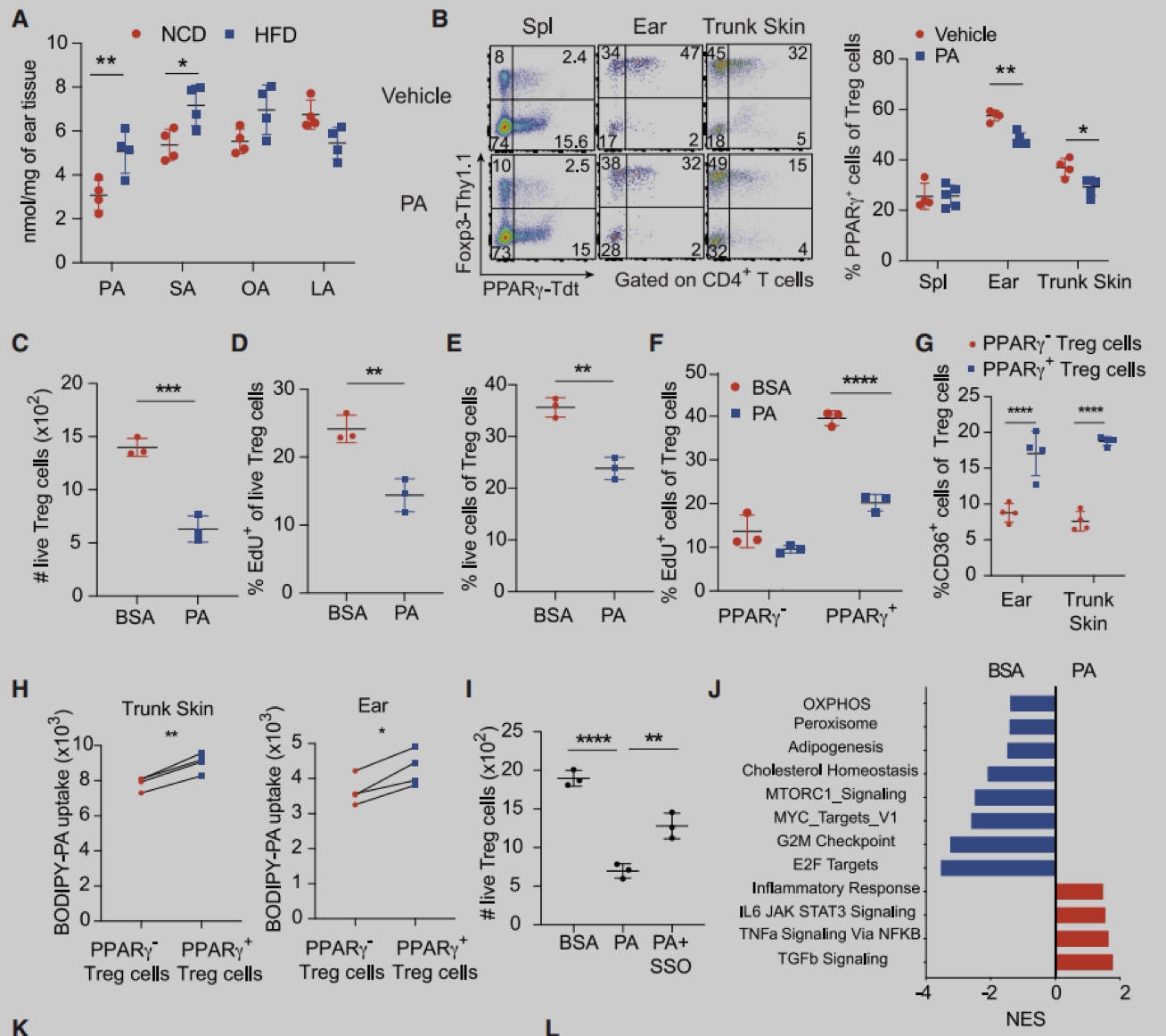
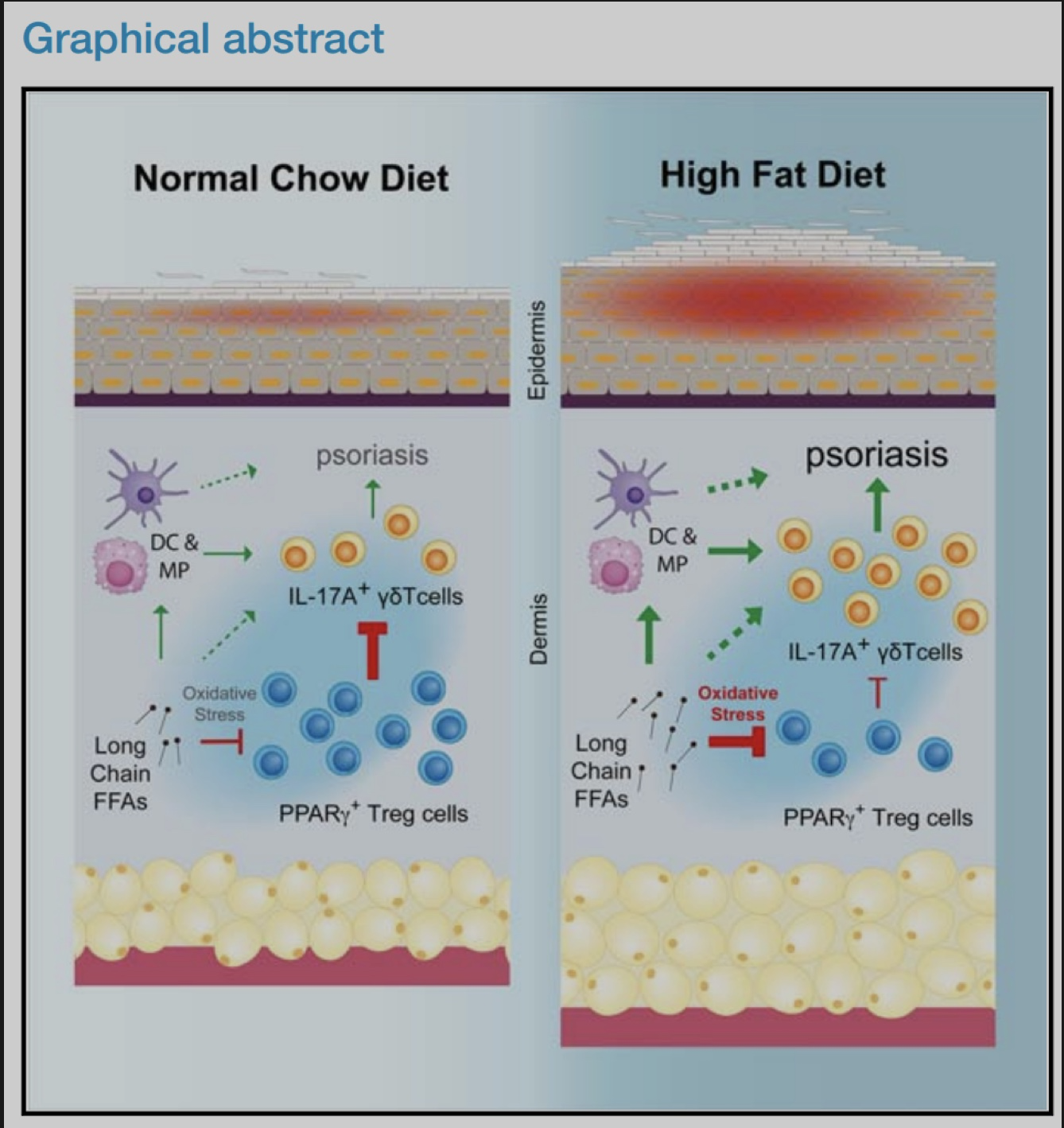
为了确定皮肤Treg特异性转录因子,作者从2周龄的Foxp3-Yfp-Cre (Foxp3-Cre) 小鼠脾脏和皮肤中分选出Foxp3+Treg细胞,进行RNA-seq分析。实验发现与脾脏Treg相比,皮肤Treg细胞富PPAR信号,且主要是PPARγ。与脾脏、皮肤引流腹股沟淋巴结 (iLN) 或肺不同,躯干皮肤和耳朵含有较大比例的PPARγ+ Treg细胞,在2-3周龄时,该群体占皮肤Treg的60%-80%,在成年小鼠中略有下降,并且人类皮肤中也存在类似群体。与皮肤PPARγ- Treg细胞相比,PPARγ+ Treg细胞增殖能力更强,ST2 (IL-33R) 和IL-10的表达更高。