戊型肝炎是一种由戊型肝炎病毒(HEV)引起的全球性传染性疾病,主要通过粪口途径传播。它会导致肝炎症状,可以感染人类、以及猪和兔子等动物,并可通过这些动物传播给人类,在全球的发病率不断上升[1]。Cas13是一种靶向RNA的CRISPR/Cas效应器,通过特异性结合和切割RNA显示出其特有的抗病毒活性。其中Cas13d是VI-D亚型效应器,相比其他VI型变体,在抑制RNA病毒方面表现出更高的效率,尤其适用于使用AAV载体进行传递[2]。然而,Cas13d系统干扰哺乳动物体内RNA病毒的活性尚不清楚,因此,利用Cas13d结合AAV体内递送系统开发新的戊型肝炎治疗方法。

为了评估病毒mRNA的抑制效果,本研究使用mCherry荧光蛋白融合HEV3-ORF构建报告系统。结果显示,crRNA1、crRNA2、crRNA3和crRNA6的干扰效果显著(p < 0.0001),荧光强度显示出mCherry荧光被有效抑制(图1A、B)。本研究鉴定出靶向HEV3基因组高效crRNA,并证明Cas13d能够高效干扰RNA。
为了更好的检测CRISPR/Cas13d系统在沙鼠体内的抗病毒能力, 本研究建立并优化了HEV感染沙鼠模型,使用5E+5 copys/mL的病毒通过腹腔注射沙鼠(图1C)。同时本研究选择了3E+12GC/mL剂量的AAV8进行体内递送。通过检测Cas13d mRNA表达和免疫荧光分析确认了AAV8成功将Cas13d送达沙鼠肝细胞中(图1D、E、F)。通过RNA-seq检测了Cas13d的特异性,结果显示没有显著的脱靶效应(图1G)。本研究建立了一个利用AAV8递送Cas13d和特定HEV crRNA序列的抗病毒平台。
为了评估Cas13d在预防病毒感染中的作用,将包装有Cas13d:crRNA的 AAV8注射到沙鼠体内,随后检测GDC9病毒感染。结果显示,HEV感染被显著抑制(图1H、I)。肝脏组织学分析显示,与仅接受GDC9注射组相比,接受Cas13d:crRNA装载 的AAV8注射的沙鼠肝脏炎症和坏死减少(图1J,K)。免疫组织化学分析证实,注射Cas13d:crRNA的AAV8组的病毒载量较低(图1L,M)。
随后,评估了Cas13d治疗戊型肝炎感染的效果。结果显示,在仅接受GDC9注射的组中观察到较高的排毒率,而注射Cas13d:crRNA的AAV8组在经过11天后排毒率迅速下降(图1N)。肝功能检测和组织学显示,Cas13d 系统在治疗戊型肝炎方面是安全且有效的(图1O、P、Q)。免疫组织化学分析显示,注射Cas13d:crRNA的AAV8 组病毒载量显著较低( 图 1R、S)。
此外,该研究还探讨了Cas13d系统缓解肝损伤的机制。肝转录组数据分析差异表达基因富集于NOD样受体信号通路、病毒蛋白相互作用、Th17细胞分化以及脂质和动脉粥样硬化途径等途径,显示与炎症、抗病毒反应和脂质代谢相关的基因发生了显著变化(图1T)。
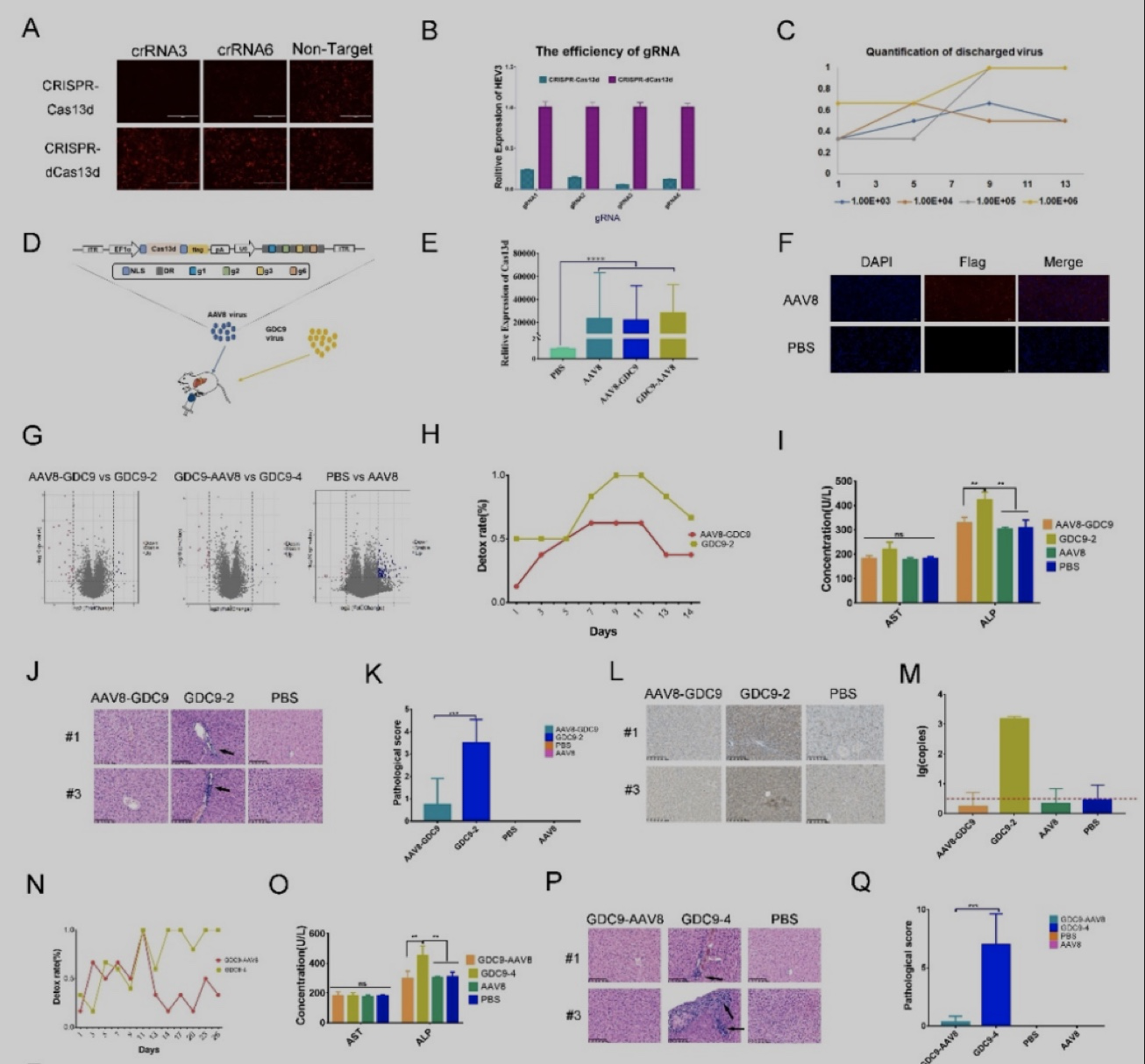
图1 CRISPR-Cas13d系统用于预防和治疗沙鼠肝炎。

