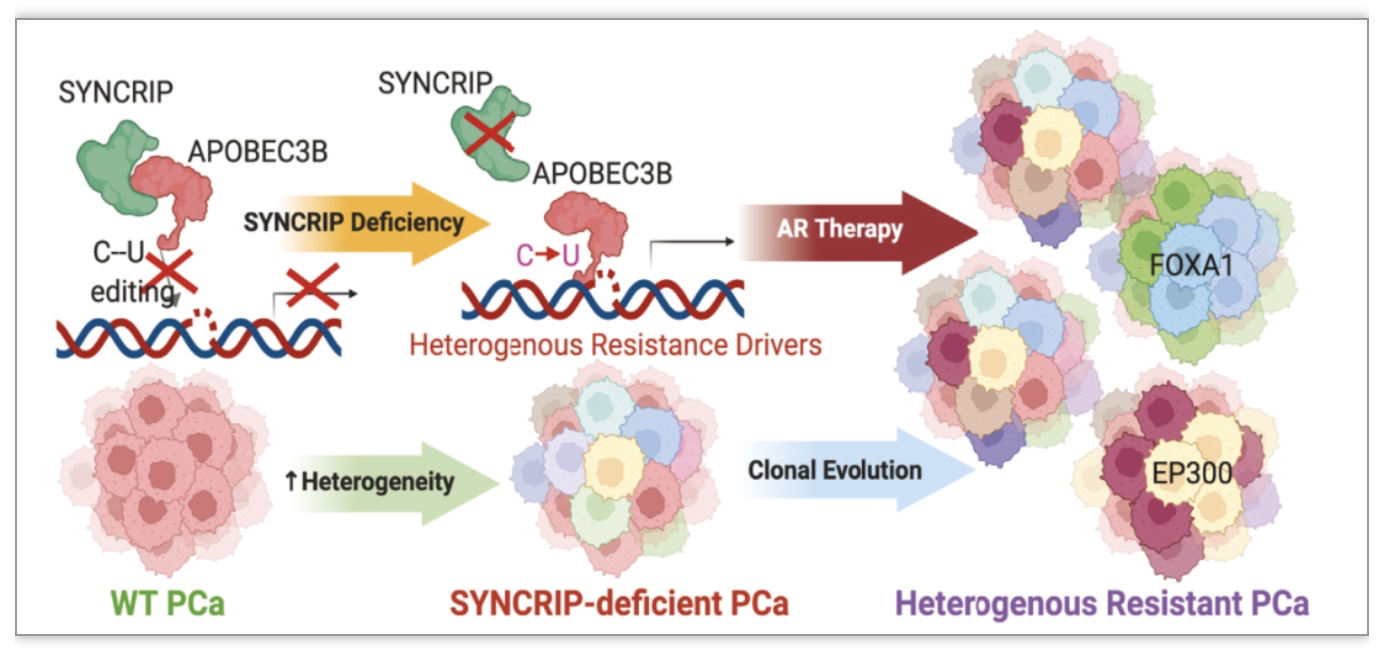
基因靶向治疗已经成为癌症治疗领域的重要手段,然而,不同的癌症对这些治疗反应各异,有些在治疗初始阶段有效的靶向疗法也会在治疗过程中迅速失效。因为肿瘤能迅速产生抗药性,使得药物失去效果,严重影响了患者的生存机会。近年来的研究发现,肿瘤DNA突变和异质性的增加可能是药物耐药性的根本原因[1]。这些突变一般由基因组不稳定性引起,但这种过程需要相当长的时间,无法解释晚期癌症患者中快速出现的抗药性新突变。随后研究人员发现,肿瘤细胞可能“劫持”正常的细胞调节机制,快速加剧突变和增加突变量,从而迅速产生抗药性。其中一个典型的例子就是DNA脱氨酶APOBEC蛋白家族[2],它们驱动的特征DNA突变在超过70%的人类癌症,包括肺癌,乳腺癌和前列腺癌中都有观察到。
他们的研究表明,SYNCRIP作为抑制APOBEC的内源分子“刹车”,可以抑制前列腺癌细胞中由APOBEC驱动的突变。当SYNCRIP缺失,APOBEC3B就会失控,在前列腺癌细胞中快速产生大量的突变,并产生对雄激素受体AR抑制剂恩杂鲁胺的抗药性。通过结合单细胞测序,3D类器官培养等技术,研究人员找到了八个关键基因:BRD7、CBX8、EP300、FOXA1、HDAC5、HSF4、STAT3和AR。这些基因被失控的APOBEC3B突变,导致前列腺癌的抗药性。更令人振奋的是,他们发现针对失控的APOBEC3B的拮抗剂可以有效地延缓突变和抗药性的产生。这项发现不仅揭示了癌细胞如何通过解除SYNCRIP抑制释放APOBEC驱动的突变,从而快速获得抗药性,也为新型抗癌药物的开发提供了新的研究方向。
研究人员通过分析小鼠的测序数据[3],确定了一个与前列腺癌治疗抗药性有关的主要候选基因,SYNCRIP。SYNCRIP是一种广泛表达的RNA结合蛋白,它主要负责调控转录后的mRNA加工过程。在前列腺癌中,SYNCRIP是最常见的缺失基因之一。这项研究发现,与正常SYNCRIP基因的患者相比,缺失SYNCRIP基因的患者在接受针对雄激素受体(AR)的治疗时,会更快地产生抗药性,这种抗药性的发生风险也会增加,而PSA(前列腺特异抗原)的反应也会显著降低。实验结果显示,那些不依赖雄激素的前列腺癌细胞系,SYNCRIP蛋白水平通常会低于依赖雄激素的细胞系(图1)。在对恩杂鲁胺(一种AR拮抗剂)敏感的细胞系进行SYNCRIP敲除后,这些细胞对恩杂鲁胺产生了显著的抗性。然而,当SYNCRIP被重新引入后,这些细胞重新对恩杂鲁胺产生了反应。使用LNCaP/AR异种移植模型,研究人员评估了SYNCRIP缺失对前列腺癌肿瘤发生和体内治疗抗药性的影响。他们发现,SYNCRIP的缺乏导致去势小鼠对恩杂鲁胺的显著抗性。在SYNCRIP缺陷的肿瘤中,细胞增殖标志物Ki67显著增加,这表明SYNCRIP的缺陷可以保护细胞免受治疗诱导的增殖抑制。
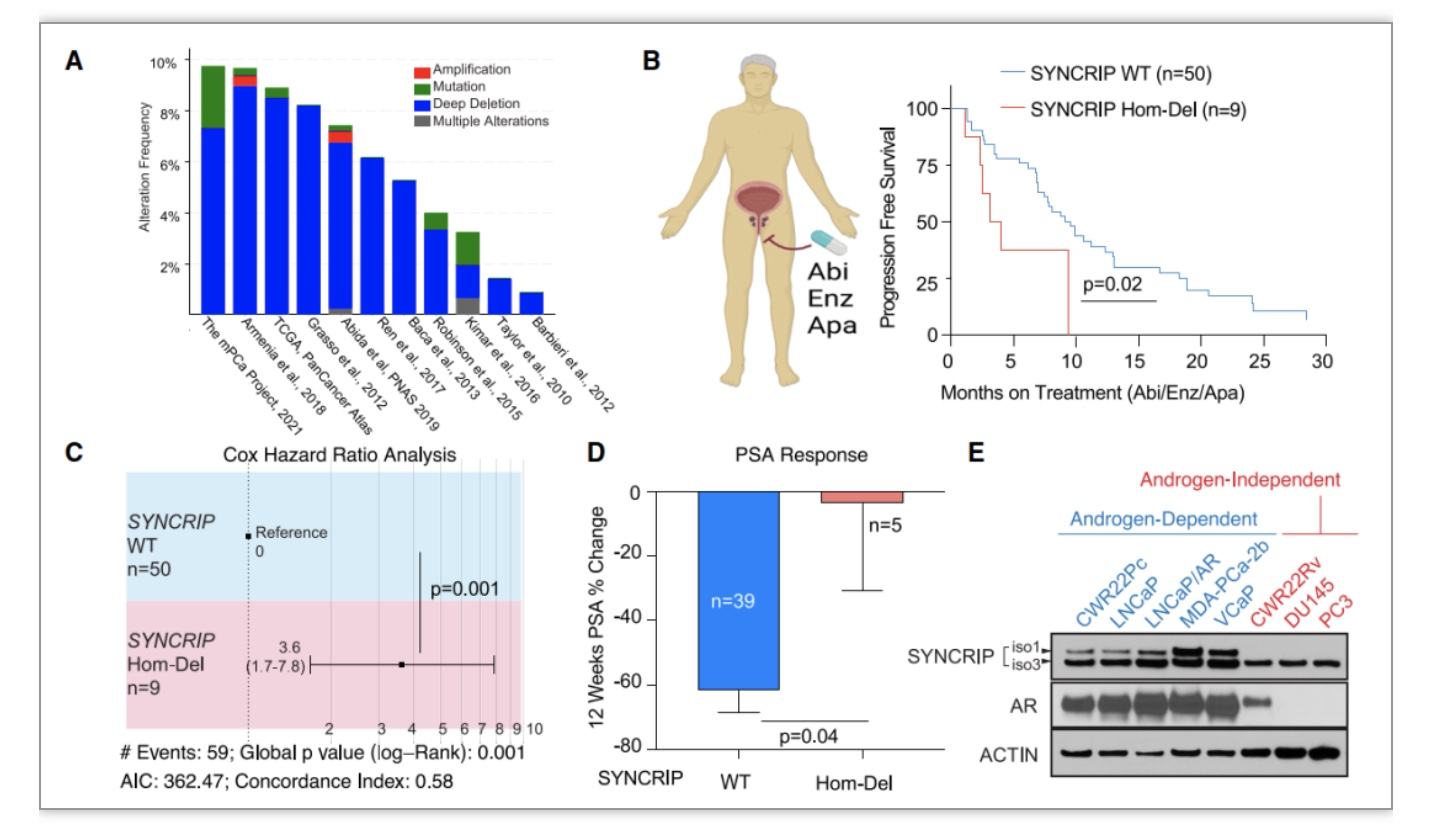
图1 SYNCRIP缺失与前列腺癌患者的生存、风险、治疗的关系
研究人员发现SYNCRIP可以抑制APOBEC家族成员APOBEC1的RNA编辑活性。这种编辑活性正常情况下会导致DNA突变,这种突变对前列腺癌中的药物抗性有重要影响。然而,在SYNCRIP缺失的细胞中,这种突变活性增加,可能导致药物抗性的增加。尤其是,研究者观察到两种与APOBEC相关的突变模式,这可能与抗药性有关。研究人员还发现,SYNCRIP可以直接与APOBEC家族的另一个成员APOBEC3B的N端区域相互作用。如果在细胞中敲除APOBEC3B,可以消除SYNCRIP缺失导致的抗药性。相反,如果在细胞中过表达APOBEC3B,会增加细胞对治疗的抗性。临床数据进一步显示,APOBEC3B高表达的患者具有更短的无进展生存期,这意味着疾病更可能持续发展。
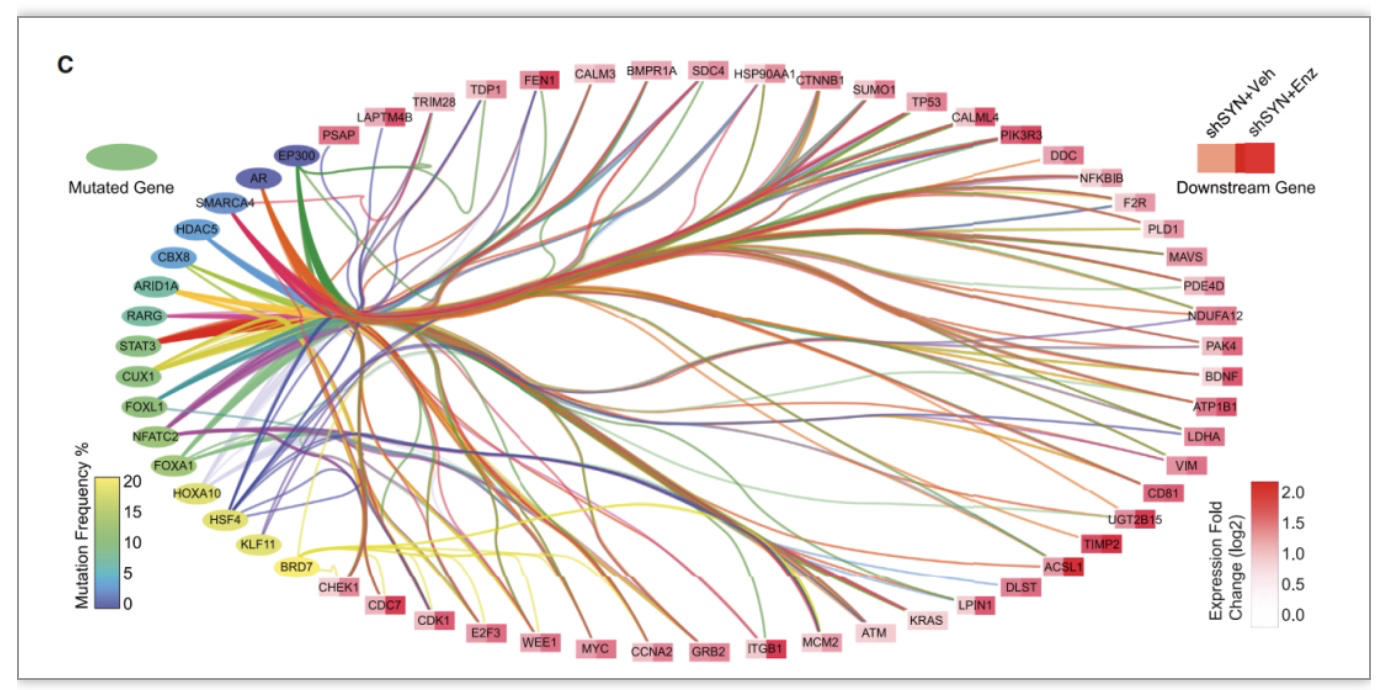
图2:通过分析转录组和外显子测序结果研究人员发现了16个被APOBEC突变的候选基因和44个可能影响的下游基因
为了进一步确定SYNCRIP缺失细胞中APOBEC家族蛋白引发突变的特定基因,研究人员利用CRISPR技术在SYNCRIP缺失的细胞中敲除了一系列基因,观察了这些基因对抗药性的影响。最终,他们找到了16个可能的候选基因和44个可能影响的下游基因。通过进一步的功能验证实验,研究人员确定了其中的8个基因是由APOBEC3B引发突变的关键基因。在SYNCRIP缺失的细胞中敲除这8个基因会降低对药物的抗性。其中,研究者们重点关注了FOXA1基因。他们发现,在SYNCRIP缺失的细胞中,FOXA1信号显著增强,而敲除APOBEC3B可以减轻这种增强效应。这表明,APOBEC3B的异常活性可能是引发抗药性的一个关键因素。为了进一步研究这8个耐药性驱动基因的作用,研究人员通过长期使用恩杂鲁胺治疗,获得了15个来自于SYNCRIP缺失且对恩杂鲁胺有抗性的异种移植来源细胞系,同时也制备了4个作为对照的细胞系。通过对比这些细胞系,他们发现SYNCRIP缺失的细胞系异质性更高,这说明SYNCRIP缺失可能增加了肿瘤细胞的异质性,这可能是它导致抗药性的一个方式。
研究人员利用单细胞RNA测序技术(scRNA-seq)对暴露于恩杂鲁胺不同时间的野生型和SYNCRIP缺失的前列腺癌(PCa)细胞进行了深入分析,以更深入地理解APOBEC引发的突变和肿瘤内部的异质性是如何推动抗药性的。他们发现,在SYNCRIP缺失的肿瘤细胞中,无论是短暂还是持久暴露于恩杂鲁胺,肿瘤内异质性(ITH)评分都会持续增加。这表明持续的APOBEC驱动突变正在推动新的抗药性细胞的出现以及肿瘤异质性的增加。为了找到导致抗药性的主要驱动因素,研究人员对所有十四个细胞聚类进行了进化轨迹分析,以揭示前列腺癌治疗耐药性的发展过程。在SYNCRIP缺失和APOBEC驱动的突变影响下,出现了多个具有抗药性的亚克隆。他们发现,FOXA1基因的突变在经过恩杂鲁胺长期暴露后产生耐药性的细胞中起着关键作用。这进一步证实了APOBEC的异常活性可能是导致治疗耐药性的一个重要因素。
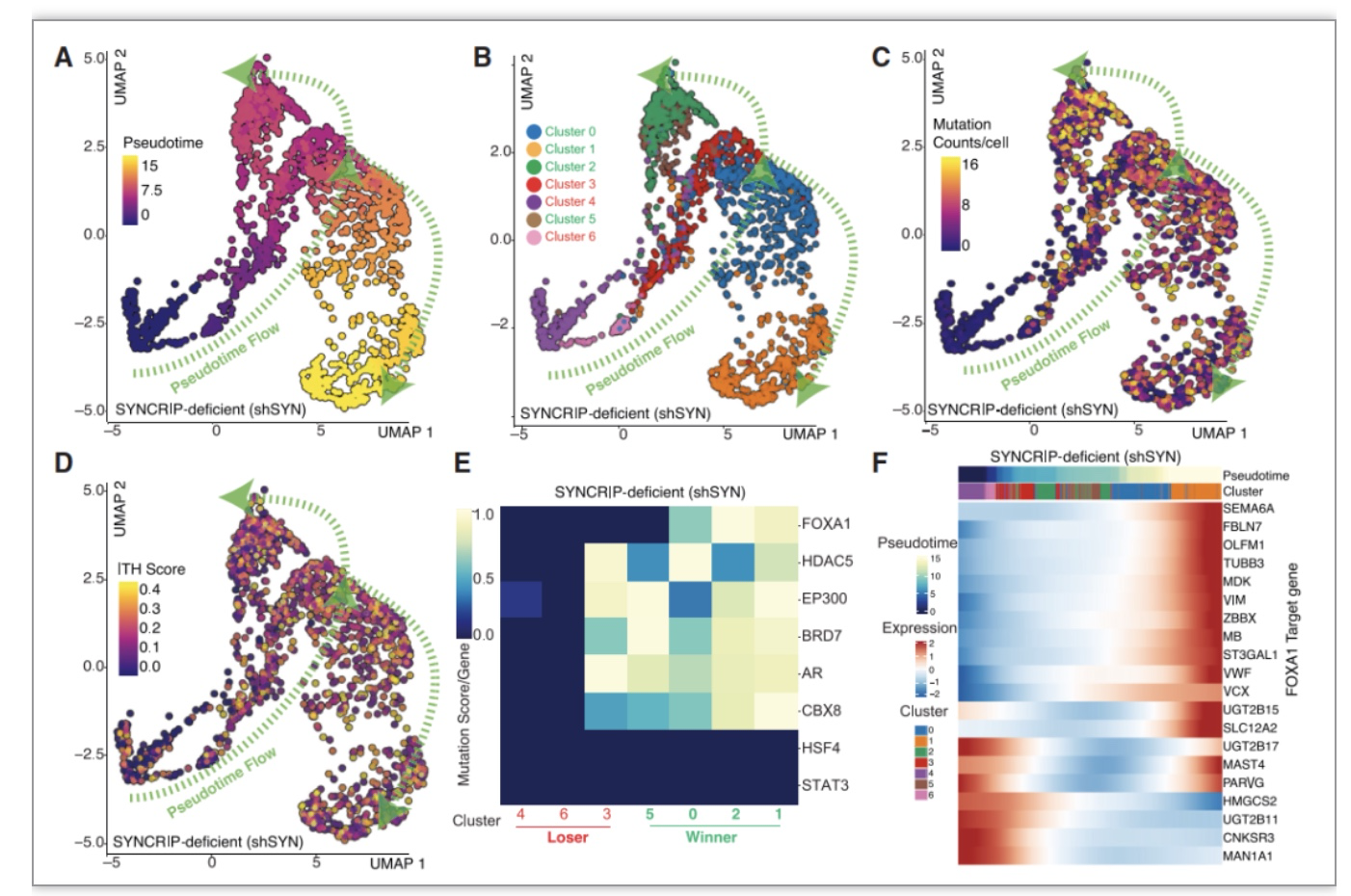
图3:单细胞转录组测序结果显示SYNCRIP缺失促进抗药性亚克隆的产生