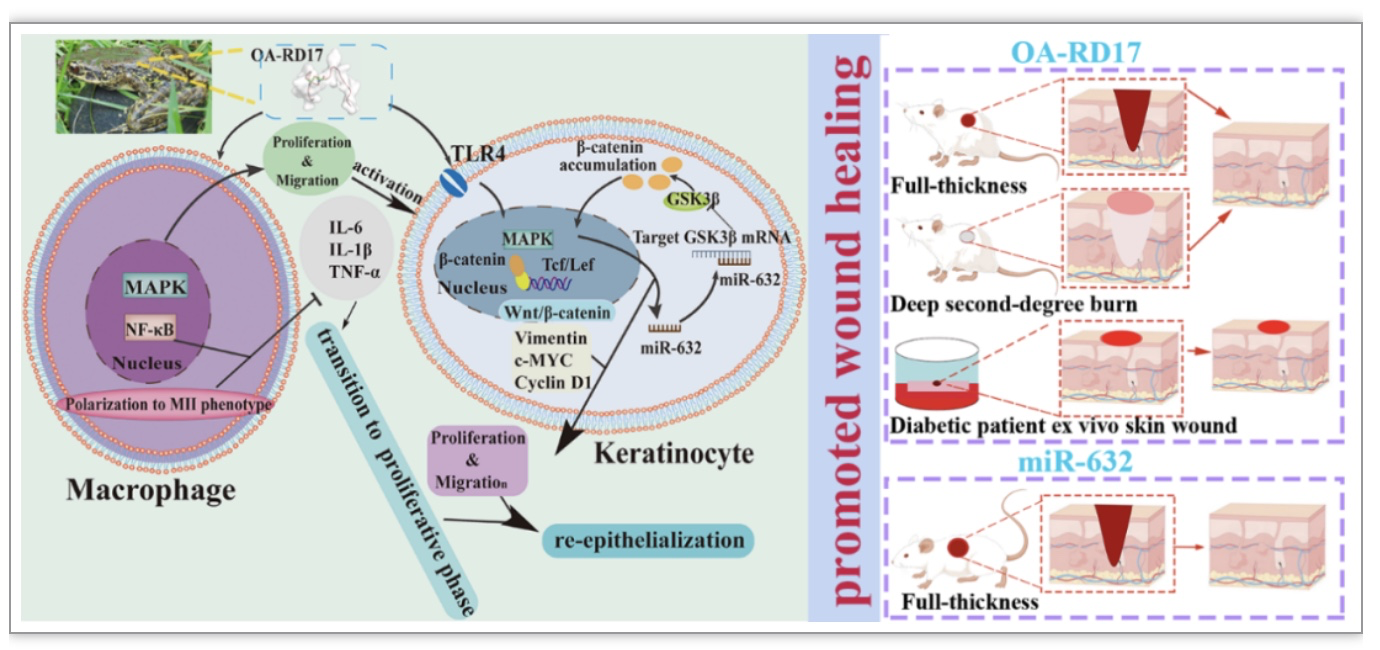
皮肤再生修复是机体精密调控的生理过程,但存在较多因素阻碍伤口愈合进展,导致慢性不愈合伤口的发生[1]。慢性不愈合伤口存在过度的炎症反应和再上皮受阻这严重阻碍了伤口修复进程,且易引起感染、溃疡、坏疽和继发性疾病的发生[2, 3]。此外,慢性不愈合伤口的治疗周期长,花费高,受影响的患者人数也在逐年增加,不仅给患者及其家庭带来严重的影响,也给全球的医疗保健系统带来沉重的负担[4]。因此,皮肤损伤后的快速高效再生修复对于机体正常生理功能重建以及减轻患者、社会的心理和经济负担具有重要意义。
尽管为了高效促皮肤组织创伤后再生已经做出了巨大努力,慢性非愈合性创伤的治疗仍是临床面临的巨大挑战之一,新型高效促皮肤组织再生药物的发掘显得重要且尤为要[5]。两栖动物来源的活性肽为临床解决慢性难愈合性创伤修复提供了新的思路,不仅仅是因为它们本身是良好的候选药物先导分子,同时它们作为分子探针对解析新的分子机制及发现药物靶标具有重要的积极作用[6]。因此,以高活性多肽作为探针分子在细胞与动物水平解析其作用机制,将为皮肤创伤治疗提供新的治疗策略,药物靶点以及为肽类药物的研发提供基础。
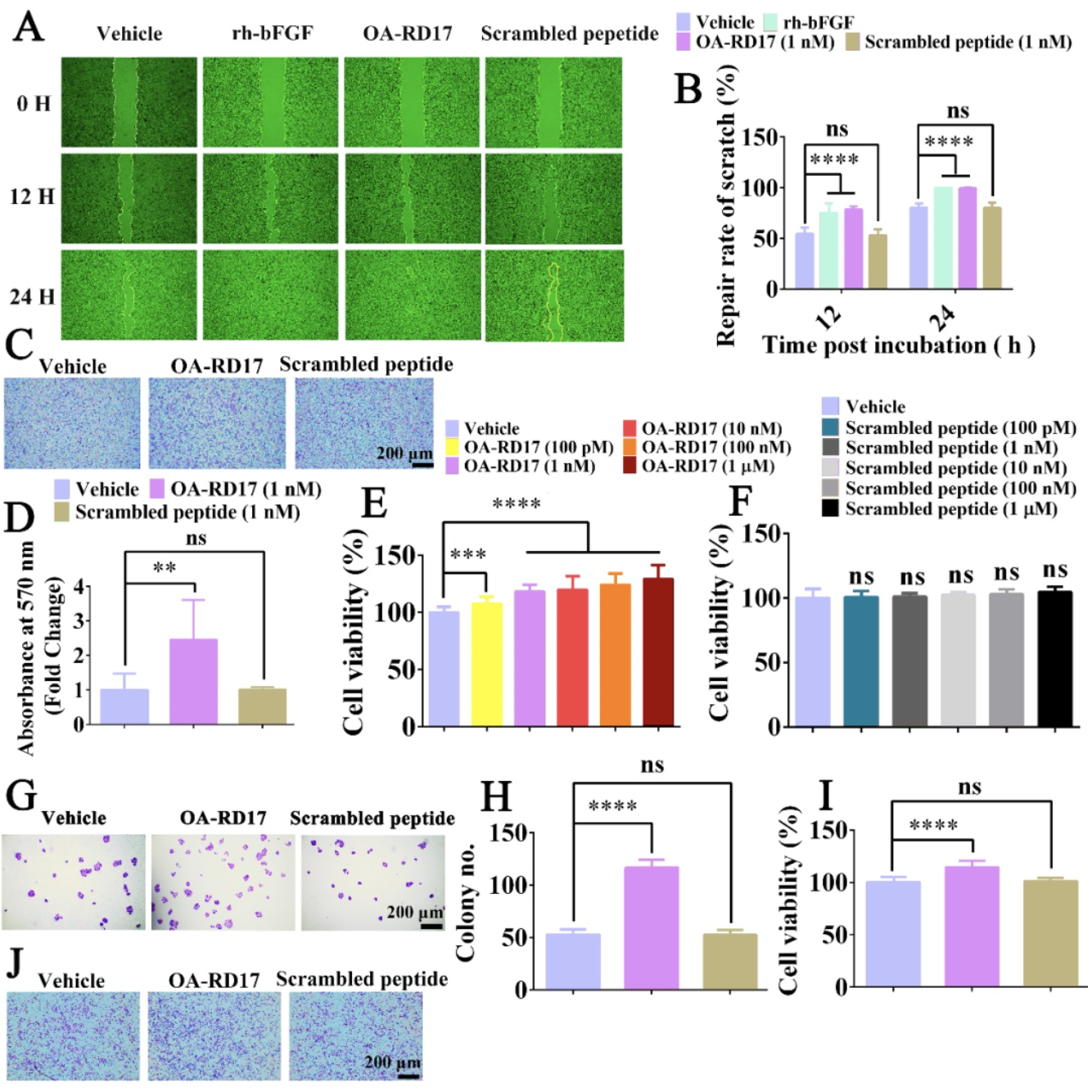
在这项新的研究中,作者首先在细胞水平构建了细胞划痕、细胞增殖、细胞trans-well迁移和细胞菌落形成实验验证了OA-RD17的促创伤修复活性。结果如图1所示,OA-RD17显著促进了角质形成细胞和巨噬细胞增殖、迁移和划痕修复,展现出良好的促创伤修复活性。
(图源:Li et al. Cellular & Molecular Biology Letters, 2023)
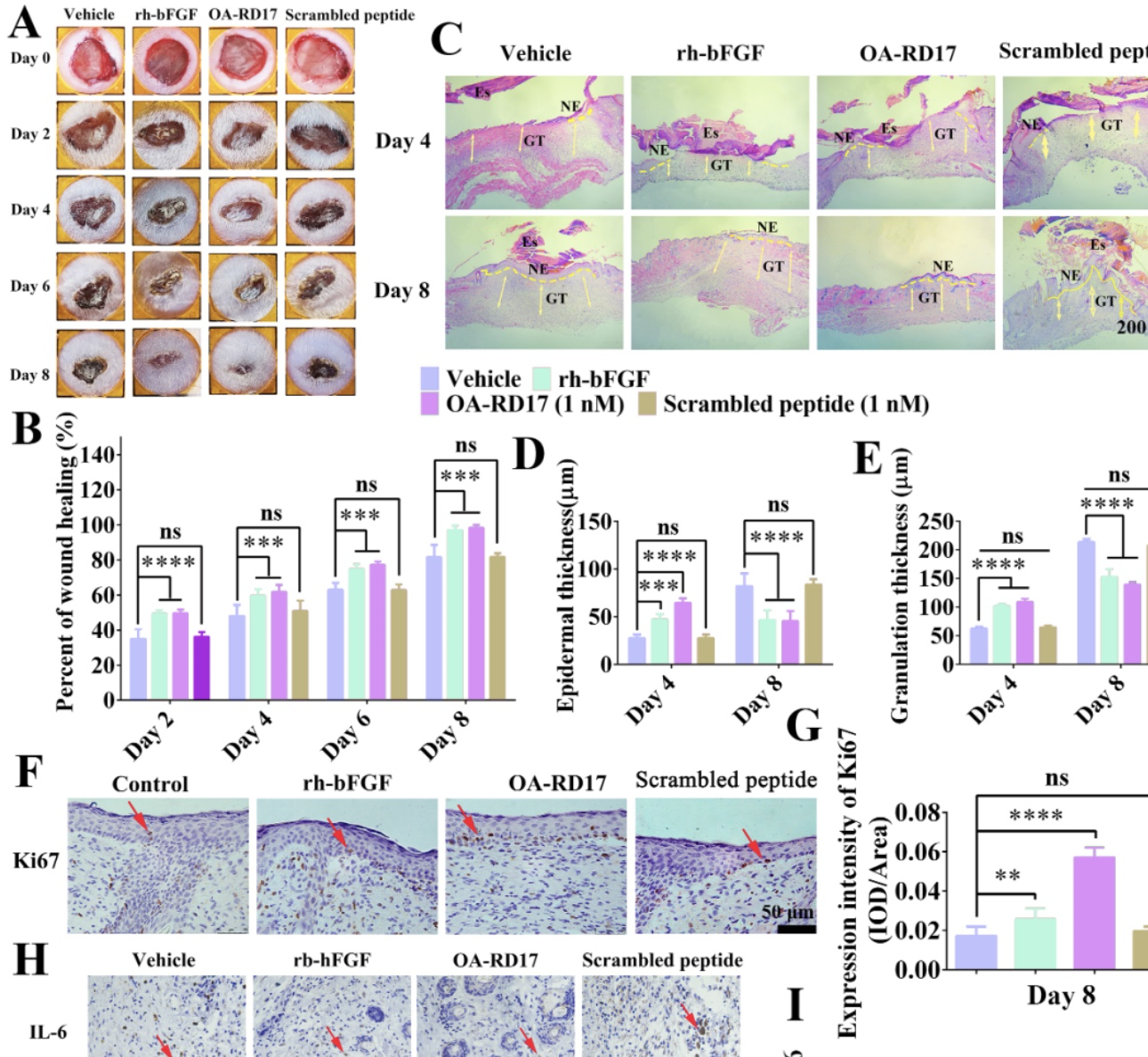
随后,在昆明小鼠背部皮肤构建了全皮层创伤和深二度烫伤模型检验OA-RD17促进皮肤伤口修复活性。研究结果如图2和3所示,相比于PBS、scrambled peptide和rh-bFGF, OA-RD17治疗后显著抑制了皮肤伤口处的过度炎症反应和促进表皮和肉芽组织再生,对小鼠全皮层创伤和深二度烫伤均展现出良好的治疗效果。
图2. OA-RD17抑制过度炎症,促进表皮和肉芽组织再生加速小鼠全皮层伤口愈合
(图源:Li et al. Cellular & Molecular Biology Letters, 2023)
(图源:Li et al. Cellular & Molecular Biology Letters, 2023)
采用糖尿病病人足部皮肤构建了离体糖尿病病人皮肤组织模拟皮肤创伤模型进一步验证了OA-RD17对人皮肤创伤的治疗效果。结果如图4所示,多肽OA-RD17连续治疗一周后,PBS治疗组的表皮厚度和迁移长度分别达到了0.07 μm和0.32 μm,OA-RD17治疗后表皮厚度以及迁移长度为0.09 μm与0.54 μm,其表皮厚度以及迁移长度分别为rh-bFGF治疗组的1.28和1.16倍。且相比于PBS和rh-bFGF,OA-RD17也显著降低了离体糖尿病病人皮肤组织IL-6、TNF-α和IL-1β的表达水平,显著抑制了过度炎症反应。
图4. OA-RD17显著促进糖尿病病人离体培养模拟全皮层皮肤伤口愈合
(图源:Li et al. Cellular & Molecular Biology Letters, 2023)
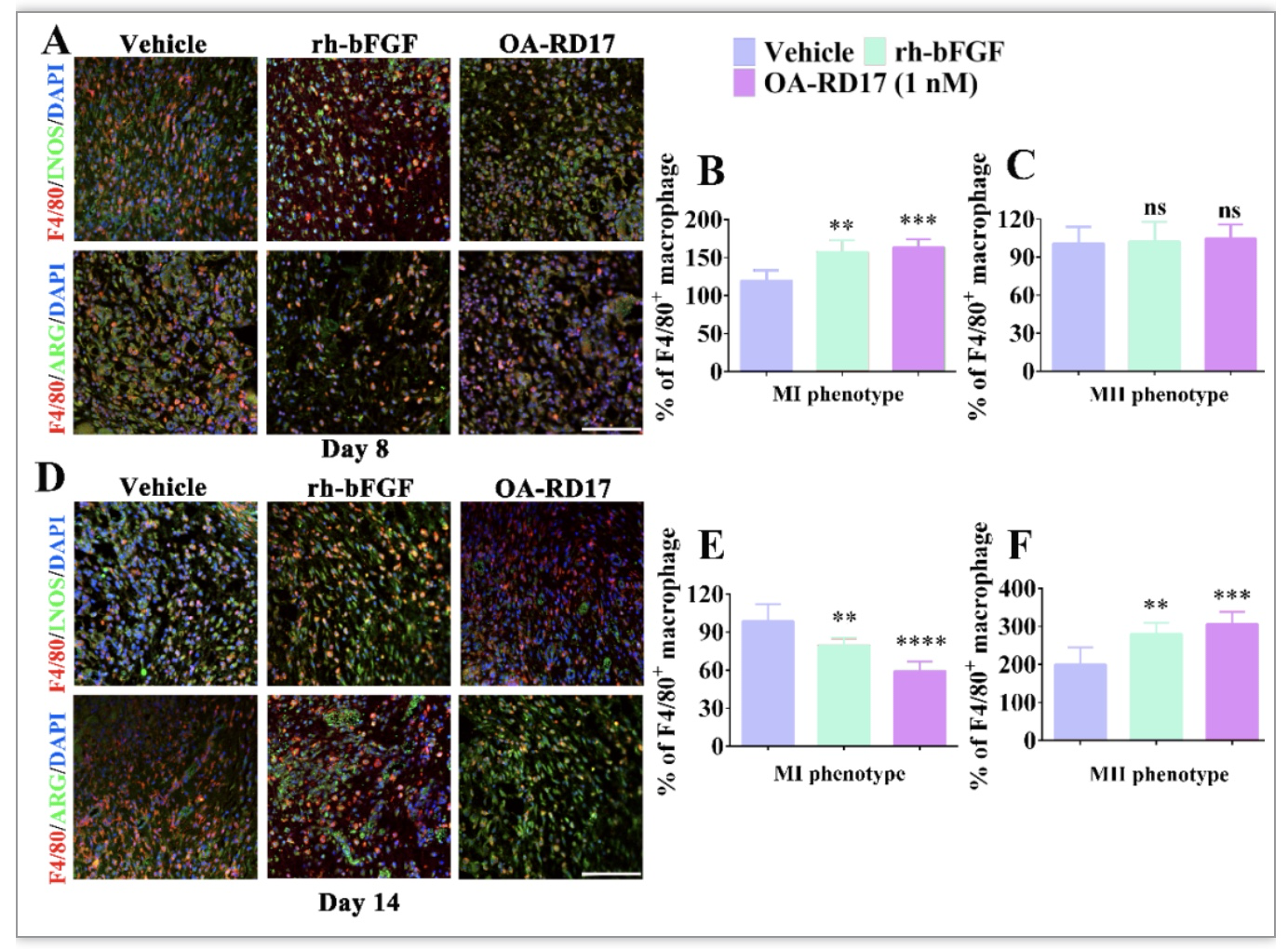
接下来,作者在细胞和动物组织水平探究了OA-RD17的促皮肤伤口愈合机制。结果如图5所示,相比于PBS和rh-bFGF,OA-RD17在治疗深二度烫伤第7天显著促进了巨噬细胞极化为MⅠ表型,对MⅡ型巨噬细胞无显著影响。然而,在OA-RD17治疗14天则显著促进了巨噬细胞由MⅠ表型极化为MⅡ表型。MⅠ型巨噬细胞具有促炎活性,而MⅡ型巨噬细胞具有抑炎活性[7, 8]。巨噬细胞由MⅠ型向MⅡ型巨噬细胞转变具有抑制过度炎症促进伤口修复进程的活性[9, 10]。此外,OA-RD17能激活巨噬细胞MAPK信号通路促进巨噬细胞增殖和迁移,且能抑制有脂多糖刺激引起的巨噬细胞过度炎症反应和NF-κB信号通路活化(图6、7)。
图5. OA-RD17调控巨噬细胞极化,促进巨噬细胞由MⅠ表型极化为MⅡ表型
(图源:Li et al. Cellular & Molecular Biology Letters, 2023)
图6. OA-RD17激活MAPK信号通路促进巨噬细胞增殖和迁移
(图源:Li et al. Cellular & Molecular Biology Letters, 2023)
图7. OA-RD17抑制脂多糖刺激引起的过度炎症因子表达和NF-κB信号通路活化
(图源:Li et al. Cellular & Molecular Biology Letters, 2023)
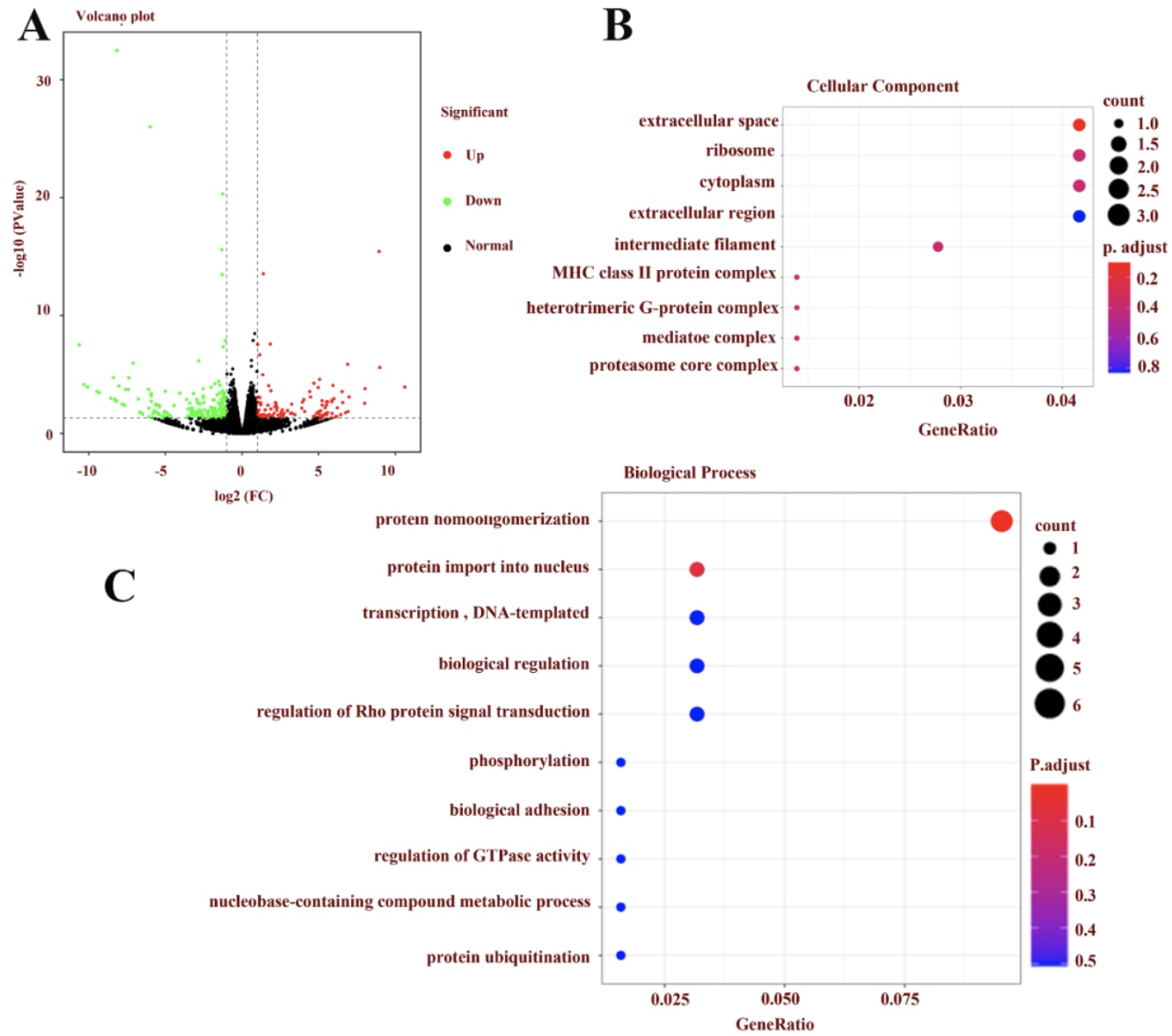
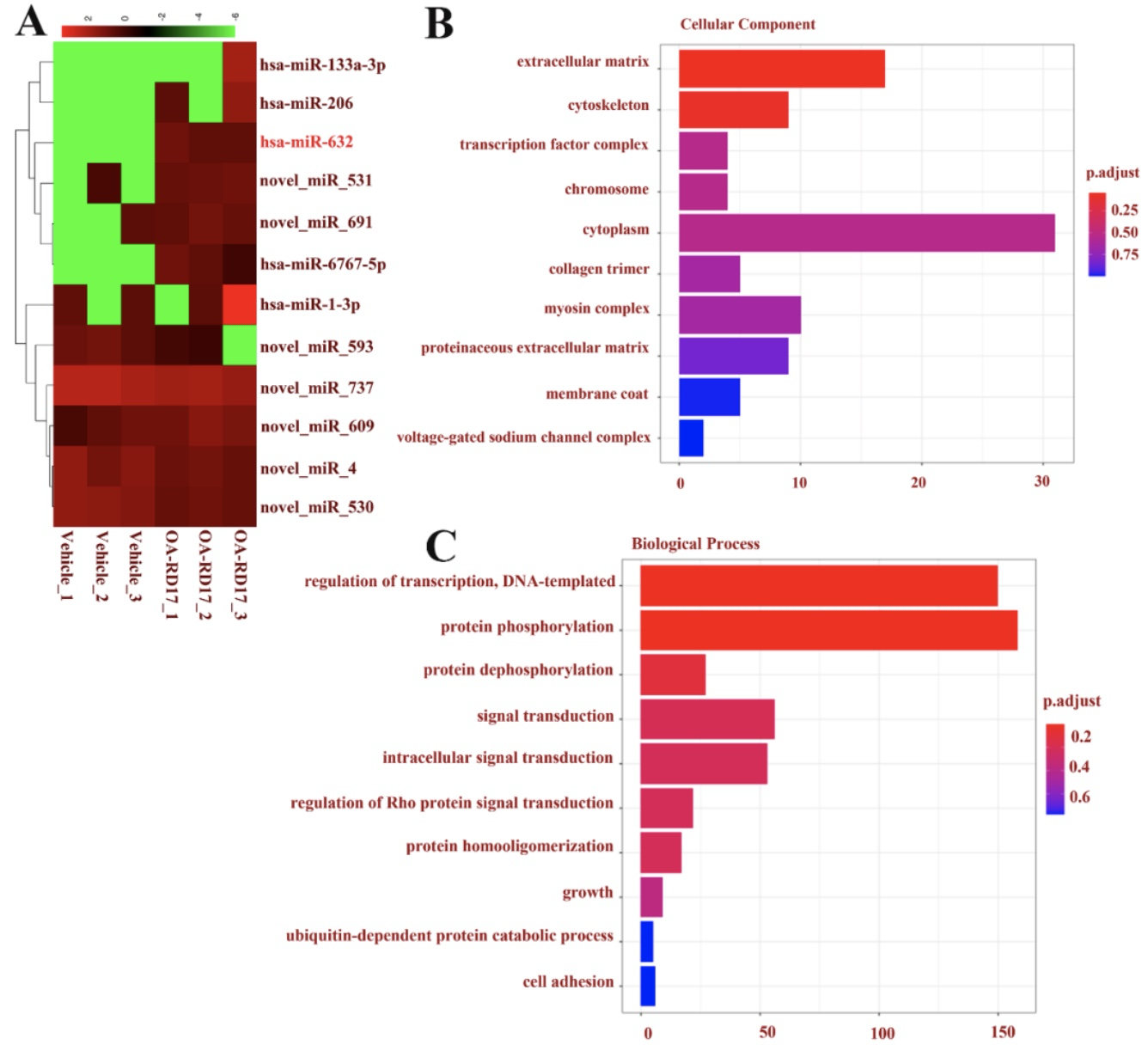
RNA 测序揭示了OA-RD17对角质形成细胞和促进皮肤伤口愈合的作用机制。在mRNA水平,OA-RD17上调了126个差异表达的基因,下调了195个差异表达的基因。且差异表达基因参与的信号通路主要包括Notch 信号通路、细胞粘附分子(CAMs)与紧密连接等,为OA-RD17具有促进角质形成细胞的增殖迁移活性提供了有力证据,也为后续研究揭示OA-RD17促进创伤修复分子机制指明了方向(图8)。表观遗传非编码RNA(miRNAs)在皮肤创伤中扮演着重要角色,探究他们在创伤修复过程中的表达差异和调控机制对慢性伤口靶向药物研发以及揭示伤口修复愈合新机制提供的见解。在miRNA水平,OA-RD17上调了8个差异表达的miRNA、下调了4个差异表达的miRNA,其中miR-632为上调最显著的miRNA,提示其对皮肤创伤修复可能发挥着重要作用。此外,OA-RD17调控的差异表达miRNAs参与的生物学进程包括蛋白质磷酸化,转录的调控,信号转导以及细胞生长等,涉及的信号通路主要包括MAPK、Focal adhesion和Wnt signaling pathway信号通路等(图9)。
图8. RNA测序检测OA-RD17调控的生物学进程和信号通路
(图源:Li et al. Cellular & Molecular Biology Letters, 2023)
图9. RNA测序检测OA-RD17调控的生物学进程和信号通路
(图源:Li et al. Cellular & Molecular Biology Letters, 2023)
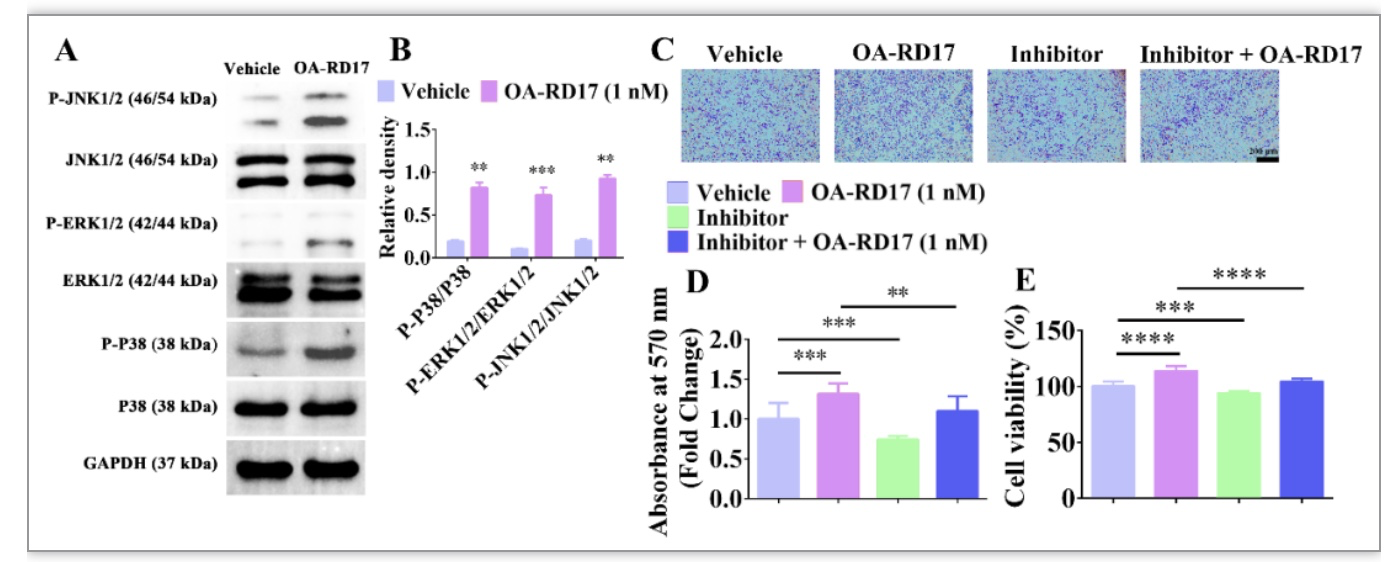
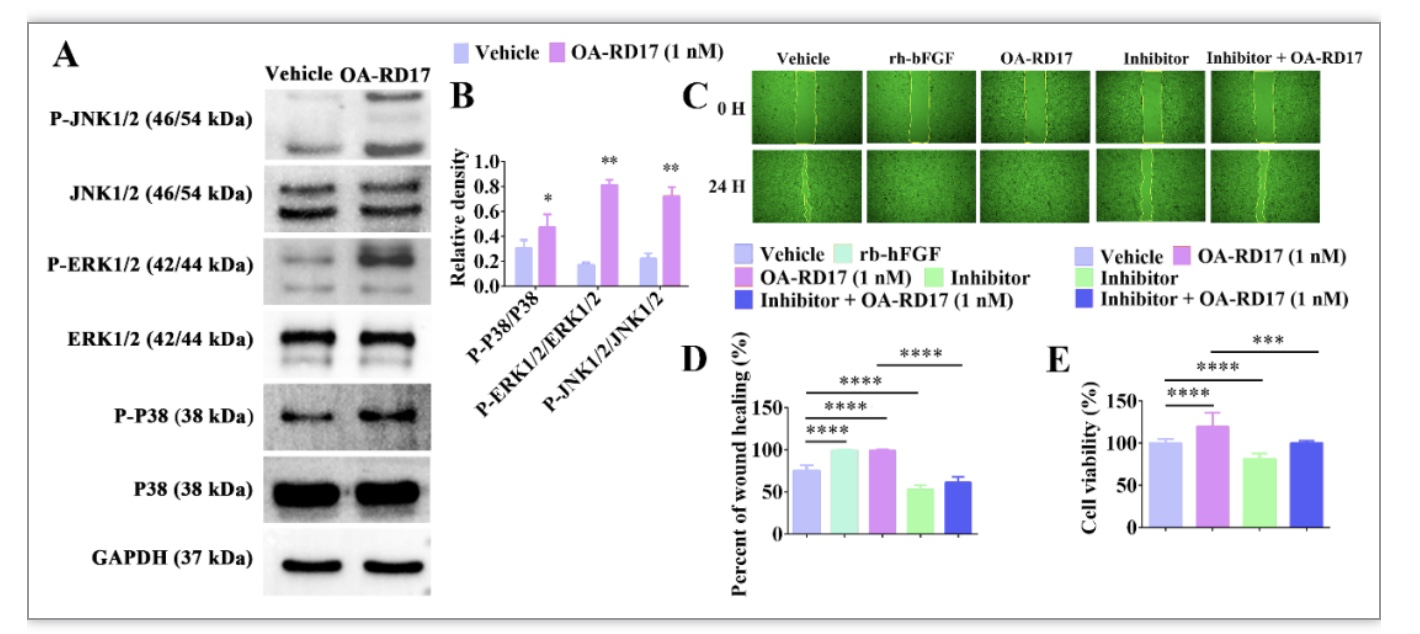
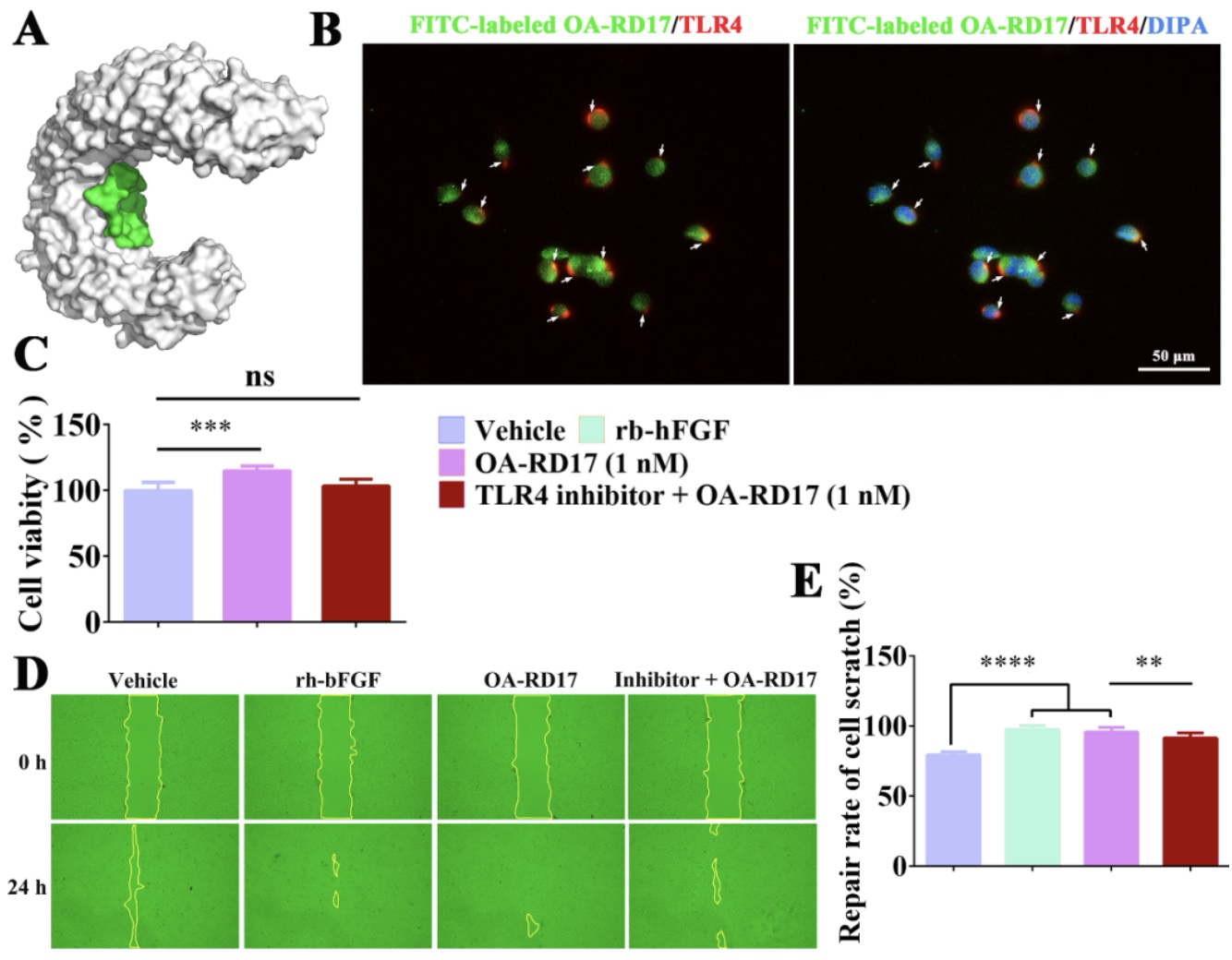
在角质形成细胞中,OA-RD17能激活MAPK信号通路,且MAPK特异性抑制剂作用后显著抑制了OA-RD17促进角质形成细胞迁移和增殖的活性,表明OA-RD17激活MAPK信号通路促进角质形成细胞增殖和迁移(图10)。蛋白质、核酸和多肽等生物大分子的作用方式为入胞或与受体作用,进而调控胞内信号发挥生物学功能[11]。分子对接结果表明,多肽OA-RD17与Toll like receptor 4 (TLR4)能通过氢键和静电作用结合于角质形成细胞的胞外区空腔内侧。此外,OA-RD17与TLR4共定位结果直接证实了OA-RD17能与TLR4结合于角质形成细胞的胞外区。更为重要的是,TLR4抑制剂作用后显著抑制剂了OA-RD17激活角质形成细胞MAPK信号通路和促进角质形成细胞增殖和迁移的活性。综上,OA-RD17通过TLR4激活MAPK信号通路促进了角质形成细胞增殖和迁移(图11)。
图10. OA-RD17激活MAPK信号通路促进角质形成细胞增殖和迁移
(图源:Li et al. Cellular & Molecular Biology Letters, 2023)
图11. OA-RD17通过TLR4激活MAPK信号通路促进角质形成细胞增殖和迁移
(图源:Li et al. Cellular & Molecular Biology Letters, 2023)
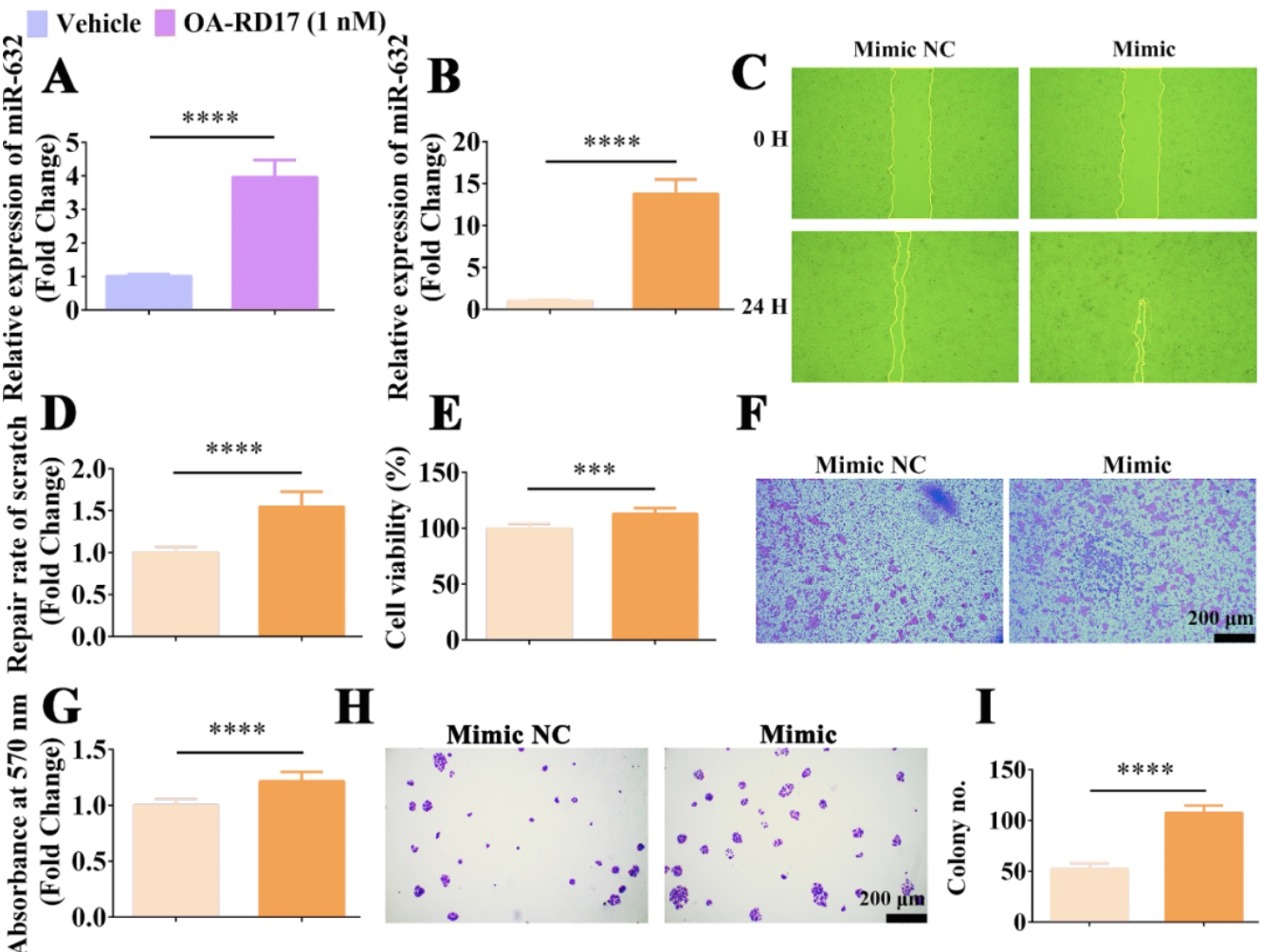
RNA测序指出miR-632为OA-RD17促进上调表达最为显著且稳定表达的miRNA,表明其可能在皮肤创伤修复中扮演着重要作用。RT-qPCR结果表明,OA-RD17(1 nM)处理角质形成细胞后显著上调miR-632的表达,且miR-632表达水平为PBS处理组的3.9倍,与RNA测序结果一致。相比于miR-632 Mimic NC,在角质形成细胞中过表达miR-632后显著促进了划痕修复、细胞增殖、细胞的迁移和菌落形成,展现出其在皮肤创伤治疗上的巨大应用潜力。
图12. OA-RD17显著上调miR-632表达,miR-632能促进角质形成细胞增殖和迁移
(图源:Li et al. Cellular & Molecular Biology Letters, 2023)
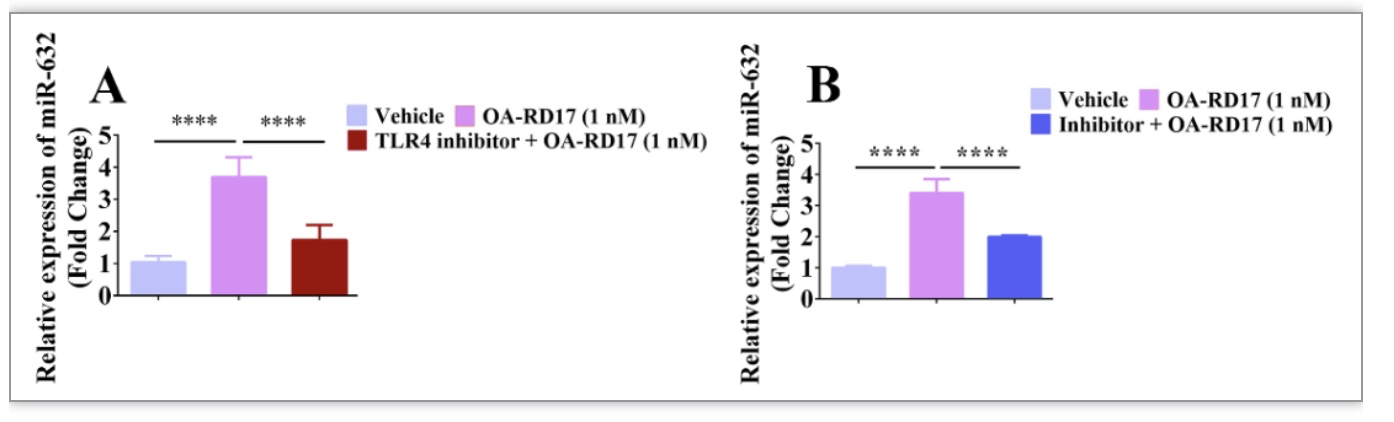
以上结果表明,在角质形成细胞中OA-RD17能通过TLR4调控了MAPK信号通路促进角质形成细胞增殖和迁移,且上调表达的miR-632对角质形成细胞增殖迁移具有重要作用。接下来作者进一步探究了OA-RD17上调miR632表达和miR-632促进角质形成细胞增殖和迁移作用机制。如图13所示,特异性TLR4和MAPK信号通路抑制剂均显著抑制了OA-RD17对角质形成细胞miR-632的上调作用,表明OA-RD17通过TLR4激活MAPK信号通路上调了miR-632表达。
图13. OA-RD17通过TLR4激活MAPK信号上调miR-632表达
(图源:Li et al. Cellular & Molecular Biology Letters, 2023)
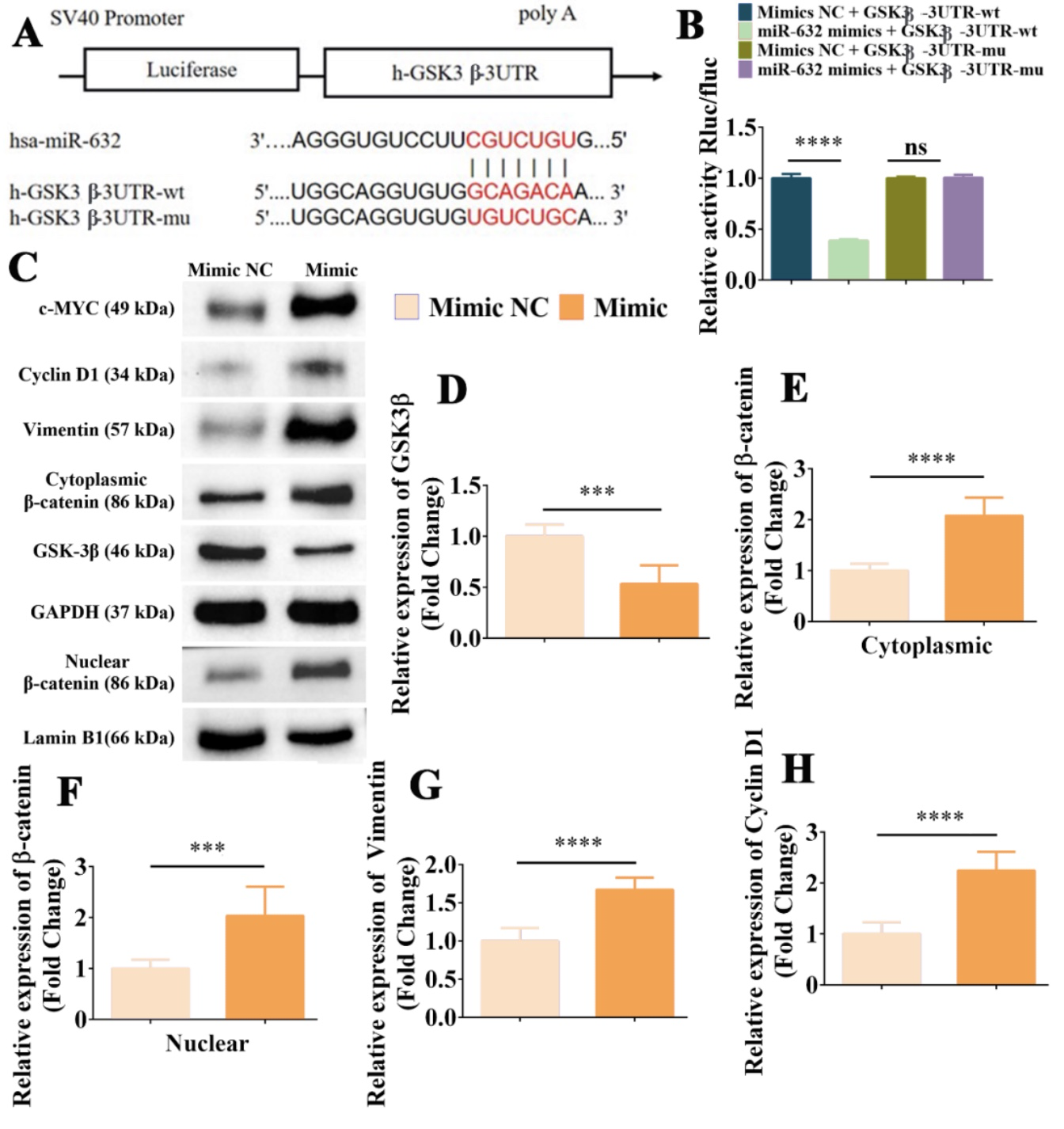
MiRNA的作用方式为靶向目的基因调控其稳定性以及影响其表达进而发挥生物学功能[12]。靶基因预测网站(https://www.targetscan.org/vert72/,http://mirdb.org/)和双荧光素酶报告基因结果表明miR-632能直接靶向GSK3β(图14)。GSK3β是Wnt/β-catenin信号通路激活的负调控蛋白,表明miR-632可能调控GSK3β进而影响Wnt/β-catenin信号通路激活促进角质形成细胞的增殖和迁移。蛋白免疫印迹杂交检测结果表明,过表达miR-632显著抑制了GSK3β的表达,提高了β-catenin、Vimentin、Cyclin D1和c-MYC的表达水平,表明miR-632能通过靶向GSK3β促进β-catenin的表达与核内转运激活了Wnt/β-catenin信号通路发挥生物学功能。值得注意的是,β-catenin抑制剂处理后显著抑制了过表达miR-632对角质形成细胞划痕修复的促进作用,其划痕修复率显著低于miR-632 Mimic NC 处理组。此外,过表达miR-632显著促进了角质形成细胞增殖,而加入β-catenin抑制剂后则显著抑制了miR-632的促细胞增殖效果。综上,miR-632通过靶向GSK3β激活Wnt/β-catenin信号通路促进角质形成细胞增殖迁移(图14)。
图14. miR-632靶向GSK3β而激活Wnt/β-catenin信号通路促进角质形成细胞增殖和迁移
(图源:Li et al. Cellular & Molecular Biology Letters, 2023)
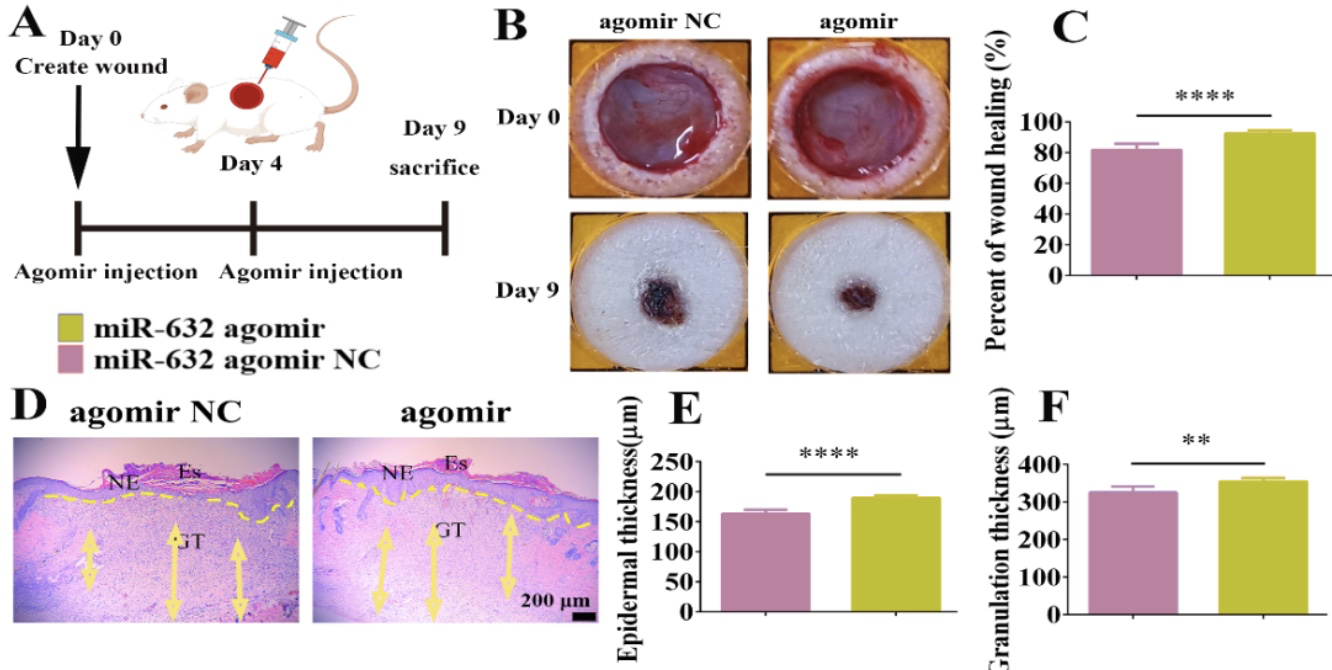
miR-632在细胞层面具有良好的促创伤修复潜力,为了更系统的探究其对动物水平皮肤创伤的治疗效果,建立大鼠SD全皮层创伤模型检测其促创伤修复活性。在小鼠皮肤伤口区域皮下注射miR-632 agomir上调miR-632表达后,探究miR-632对皮肤伤口的治疗效果。结果表明上调miR-632表达后显著促进了大鼠全皮层皮肤伤口愈合,其伤口修复率达到了92.4%显著高于NC组的81.7%。此外,上调miR-632表达显著促进了再上皮化和肉芽组织再生,以及激活了Wnt/β-catenin信号通路,该结果表明上调miR-632激活Wnt/β-catenin信号通路促进再上皮化和肉芽组织再生加速大鼠皮肤伤口愈合(图15)。
图15. miR-632靶向GSK3β而激活Wnt/β-catenin信号通路促进角质形成细胞增殖和迁移
(图源:Li et al. Cellular & Molecular Biology Letters, 2023)
图16. miR-632激活Wnt/β-catenin信号通路促进大鼠全皮层伤口愈合
(图源:Li et al. Cellular & Molecular Biology Letters, 2023)
综上,本研究通过基因组学手段从云南产两栖动物臭蛙皮肤中识别了一个新型活性肽分子OA-RD17,其只有17个氨基酸残基组成,除含一对分子内二硫键外化学修饰且没有毒性。在低浓度下(1 nM)即可在体、内外发挥显著的促皮肤修复作用,更为重要的是其对糖尿病病人足部皮肤模拟全皮层伤口也展现出良好治疗效果。进一步探究其作用机制表明,多肽OA-RD17通过调控NF-κB信号通路和巨噬细胞极化,抑制炎症因子表达,促进伤口修复由炎症期向增殖期转变。此外,OA-RD17抑制角质形成细胞释放炎症因子,并通过结合TLR4激活MAPK通路促进角质形成细胞增殖与迁移,同时上调miR-632表达。miR-632能抑制GSK3β表达并促进Wnt/β-catenin通路活化,以正反馈方式促进角质形成细胞增殖与迁移进而加速皮肤伤口修复。值得注意的是,使用OA-RD17作为分子探针,本研究首先提供证据表明 “TLR4/MAPK” 和 “Wnt/β-catenin” 与角质形成细胞的增殖和迁移以及皮肤伤口愈合密切相关。此外,我们的结果表明OA-RD17和miR-632是有希望的促皮肤创伤愈合候选药物。