噬菌体是地球上数量最庞大的生物群体,是原核生物的病毒,对维持地球生态系统的有序运行意义重大。在噬菌体和宿主漫长的军备竞赛中,为抵御噬菌体的入侵,原核生物进化出了多种系统进行防御,例如限制修饰系统、CRISPR-Cas系统,以及近来不断涌现的多种引起流产感染的系统等[1]。其中,CRISPR-Cas系统是已知的唯一一种适应性免疫系统。相应的,噬菌体进化出了anti-CRISPR蛋白抑制Cas蛋白的切割,从而保持自身基因组完整。在已知的两大类六种类型CRISPR-Cas系统里,第二大类II型的Cas9效应蛋白已被广泛应用于基因编辑,具有简单、高效的优势。针对Cas9的anti-CRISPR蛋白也不断被鉴定。对于anti-CRISPR抑制机理的阐释,不仅可以增进人们对噬菌体与宿主间相互竞争关系的理解,而且有助于后续基因编辑工具的开发。
AcrIIC4由副流感嗜血杆菌(Haemophilus parainfluenzae, Hpa)的前噬菌体编码,对II-C型Cas9具有广谱抑制活性[2]。体外和体内实验均表明,AcrIIC4在基因编辑过程中能高效抑制Cas9的活性,具有被开发为基因编辑调控工具的潜力。然而,由于缺乏AcrIIC4和Cas9复合物的结构,AcrIIC4发挥抑制的精确机制还不明确。近期有两项工作说明AcrIIC4通过阻止DNA的结合来实现抑制[2, 3],还有一项工作提示AcrIIC4可能从空间上阻止核酸内切酶结构域HNH移动到切割位点附近,从而实现抑制[4]。因此,在AcrIIC4能否阻止DNA结合方面存在争议。针对上述科学问题,该研究首先解析了HpaCas9,AcrIIC4与向导RNA (sgRNA)结合的三元复合物的结构(图1),发现AcrIIC4结合到Cas9的两个识别结构域REC1和REC2之间,并与sgRNA建立了广泛相互作用。
接着,针对AcrIIC4是否阻止Cas9识别DNA的问题,研究人员成功体外重组了AcrIIC4和DNA同时结合到Cas9-sgRNA上的四元复合物,并利用冷冻电镜的手段解析了该四元复合物的结构。同时,还解析了在没有AcrIIC4存在的情况下,Cas9-sgRNA与DNA结合的三元复合物的晶体结构(图2)。比较两个结构,研究人员发现有AcrIIC4存在时,靶标链(TS)和sgRNA只能形成七个碱基的异源双链配对,R-loop不能完全形成;没有AcrIIC4存在时,二十四个碱基的异源双链配对能完全形成。因此,由于AcrIIC4的结合,R-loop的形成被阻断在中间步骤。
比较三种HpaCas9复合物的结构,作者发现主要差别是在REC2结构域的构象上(图3A)。在有AcrIIC4结合时,不管有无DNA存在,REC2结构域构象相近,DNA:RNA异源双链结合通道被阻断。而没有AcrIIC4结合时,REC2结构域呈外翻的构象,异源双链结合通道打开。由此可见,AcrIIC4的结合能够将REC1与REC2结构域绑定到一起,限制REC2的自由运动。
接着,研究人员通过生化实验手段检测REC2运动受限导致的影响。当双链DNA的靶标链和非靶标链(NTS)提前解链时,AcrIIC4不再能够完全抑制Cas9对dsDNA的切割(图3B),说明DNA两条链的配对对于AcrIIC4发挥抑制很重要,后者可能抑制双链解链。而且,凝胶迁移实验表明AcrIIC4能降低Cas9与DNA的结合,而对配对区为单链的DNA的结合无影响(图3C)。这一结合实验也佐证了AcrIIC4能抑制双链解链这一观点。进一步的实验证明,AcrIIC4能阻止双链DNA在PAM远端解链(图3D),并对TS-guide RNA结合通道的形成有负面影响(图3E),以此阻止完整R-loop的形成,终止后续别构激活。
此外,AcrIIC4对II-C型Cas9同源蛋白的抑制能力差异较大。该研究通过一级序列和三维结构比对,结合体外切割实验,发现两种Cas9的sgRNA在第一个茎环结构处的长度不同是导致这种差异的原因(图4A-C),这对在不同Cas9编辑系统中应用AcrIIC4具有指导意义。另外,在该工作中研究人员捕捉到了AcrIIC4的两种不同构象。静态光散射实验表明,AcrIIC4在水溶液中是单体。AcrIIC4具有的长螺旋能够发生弯折变成两段(图4D-E)。
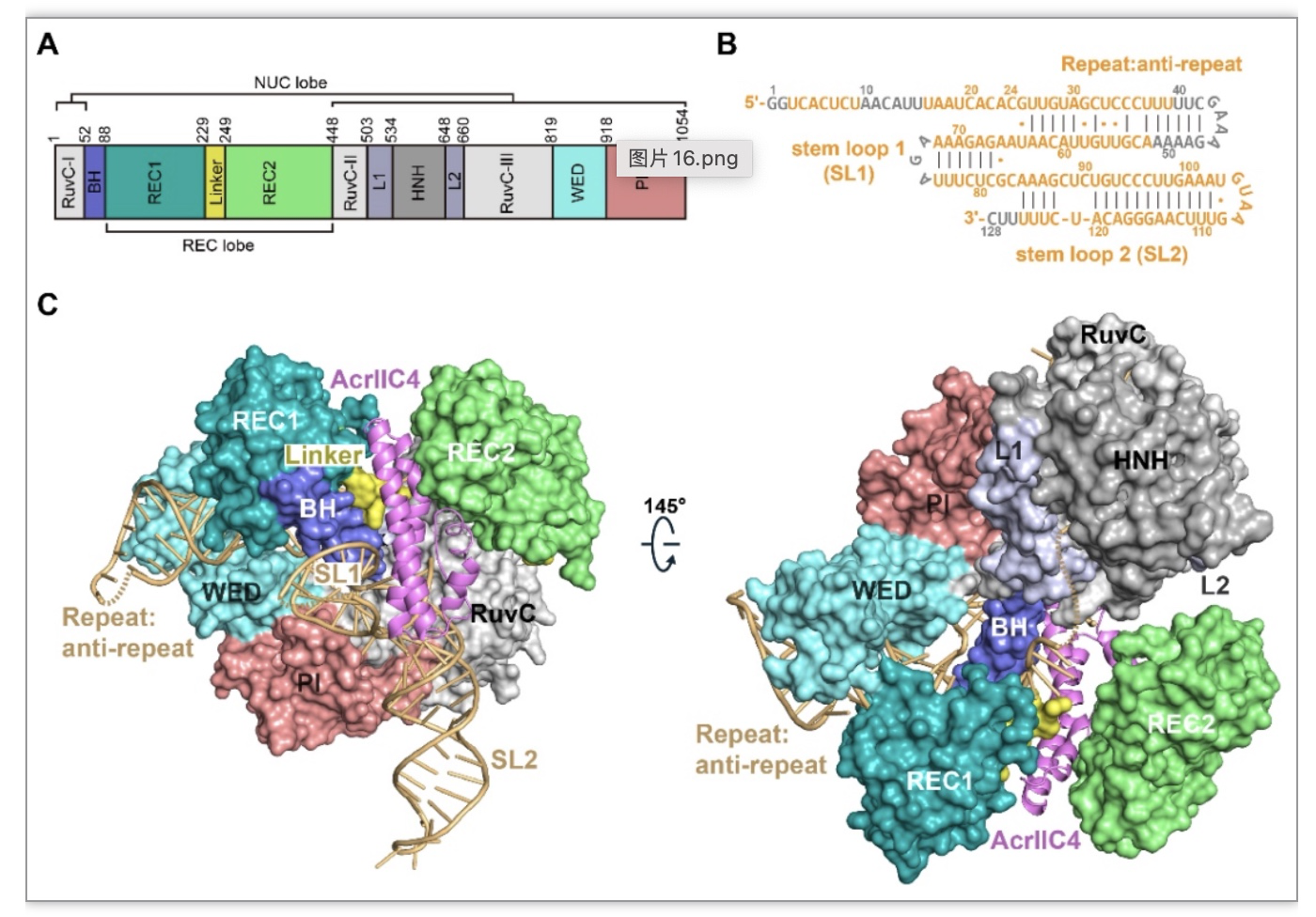
图1. HpaCas9-sgRNA-AcrIIC4三元复合物的结构
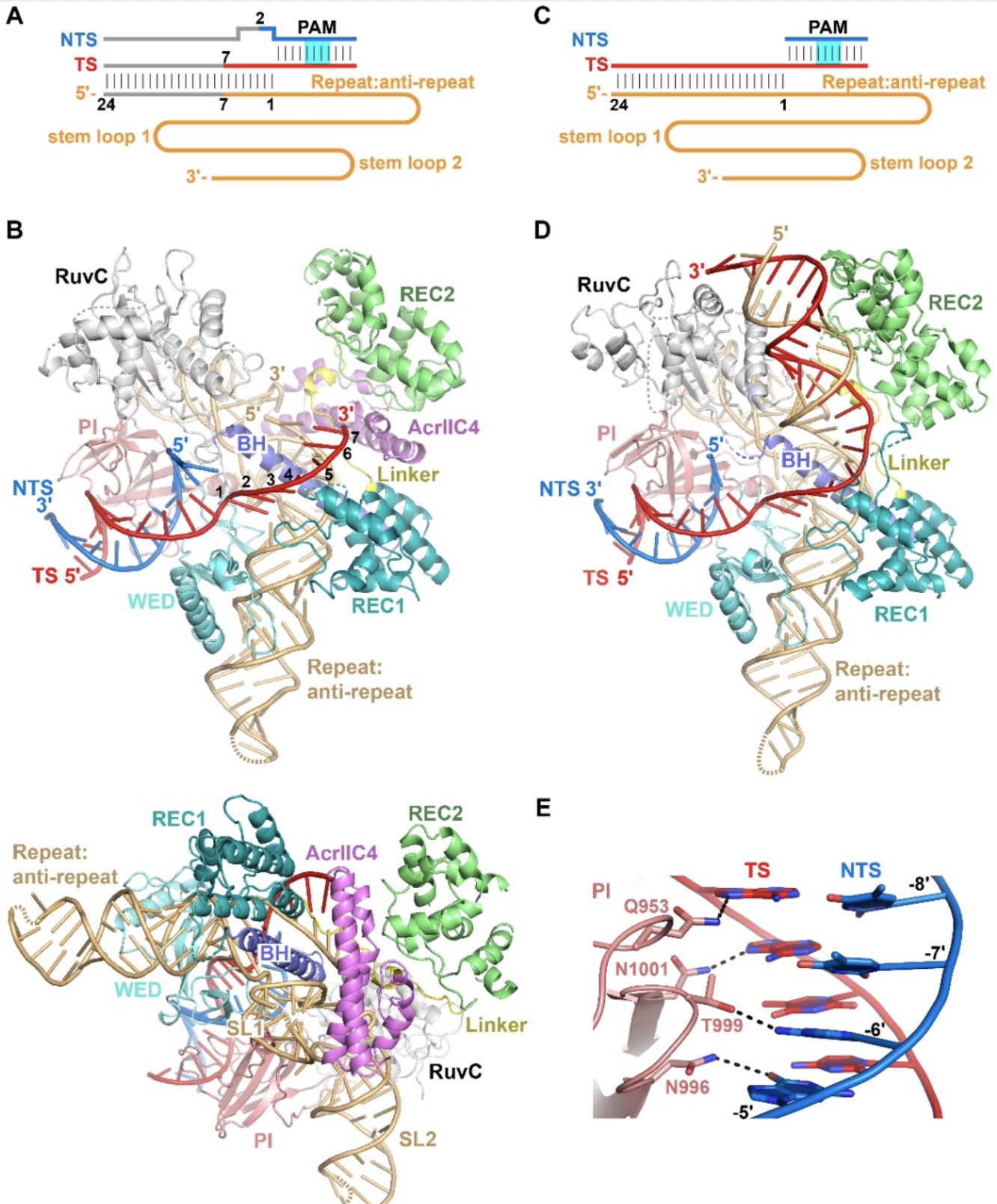
图2. HpaCas9-sgRNA-AcrIIC4-DNA四元复合物和HpaCas9-sgRNA-DNA三元复合物的结构
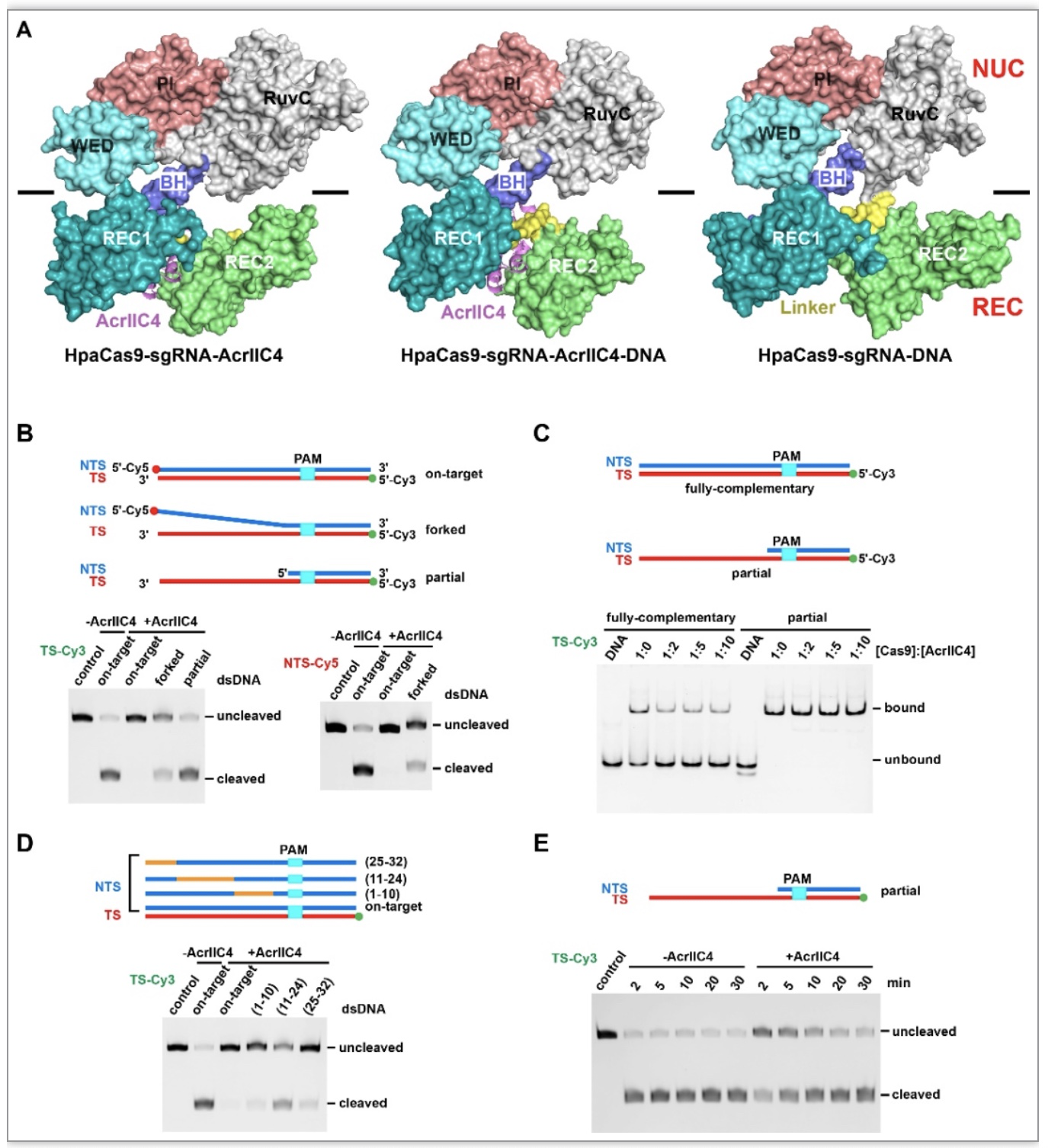
图3. AcrIIC4的抑制能力受双链DNA的靶标链和非靶标链部分提前解链的影响

图4. SgRNA的长度不同影响AcrIIC4抑制能力及水溶液中AcrIIC4的聚集状态的探讨

