T细胞急性淋巴细胞白血病(T-cell acute lymphoblastic leukemia, T-ALL)占儿童ALL病例的10%-15%,占成人ALL病例的20%-25% [1]。虽然大多数患者在接受强化化疗后生存率显著提高,但复发/难治T-ALL的治疗仍面临严峻挑战。
目前,已有不少研究探索了靶向CD7, CD5, CD4, CD1a和TRBC1的CAR-T细胞疗法治疗T-ALL。但是在肿瘤治疗过程中,可能会出现肿瘤抗原丢失和复发,比如当B细胞恶性肿瘤患者接受 CD19 CAR-T 治疗后出现CD19阴性肿瘤复发时,靶向 CD22或BAFF-R的 CAR-T细胞可清除对CD19 CAR-T细胞无应答的复发肿瘤[2,3]。因此,寻找CAR-T治疗T-ALL的新靶点对于临床研究具有重要意义。
CD38是一个单链Ⅱ型跨膜糖蛋白,稳定且高表达在T-ALL患者的肿瘤细胞表面[4]。靶向CD38的单克隆抗体Daratumumab于2015年被FDA批准用于治疗多发性骨髓瘤。近些年来,Daratumumab治疗复发/难治T-ALL取得了较好的效果,促使了CD38 CAR-T免疫疗法治疗T-ALL的研究[5]。然而,尽管CD38 CAR靶向治疗多发性骨髓瘤,B细胞急性淋巴细胞白血病和急性髓系白血病取得了重大的突破,但CD38 CAR-T治疗T-ALL的研究仍比较匮乏。

由于CD38在T细胞表面也表达,因此CD38 CAR-T细胞之间会存在自相残杀,导致CD38 CAR-T细胞活率持续下降,在体外不能持续扩增。
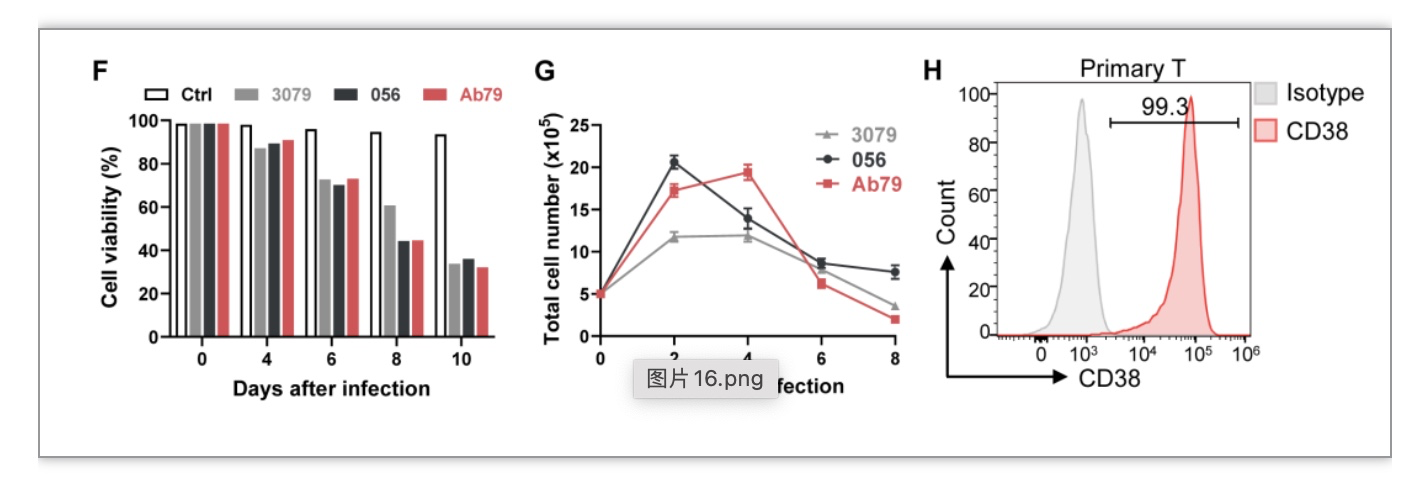
图1. T细胞表面CD38的表达导致CD38 CAR-T细胞自相残杀,限制CD38 CAR-T细胞扩增
为了解决自相残杀,作者使用CRISPR/Cas9技术敲除了CD38基因。Eyquem et al.曾报道将CD19 CAR基因定向插入到T细胞的TRAC位点能够增强CAR-T细胞的功能[6],因此作者在敲除CD38基因的同时将 CD38 CAR基因定向插入到TRAC位点制备了CD38KOTRACKI CAR-T细胞,比通过逆转录病毒制备的CD38KORV CAR-T细胞具有更好的体外功能。
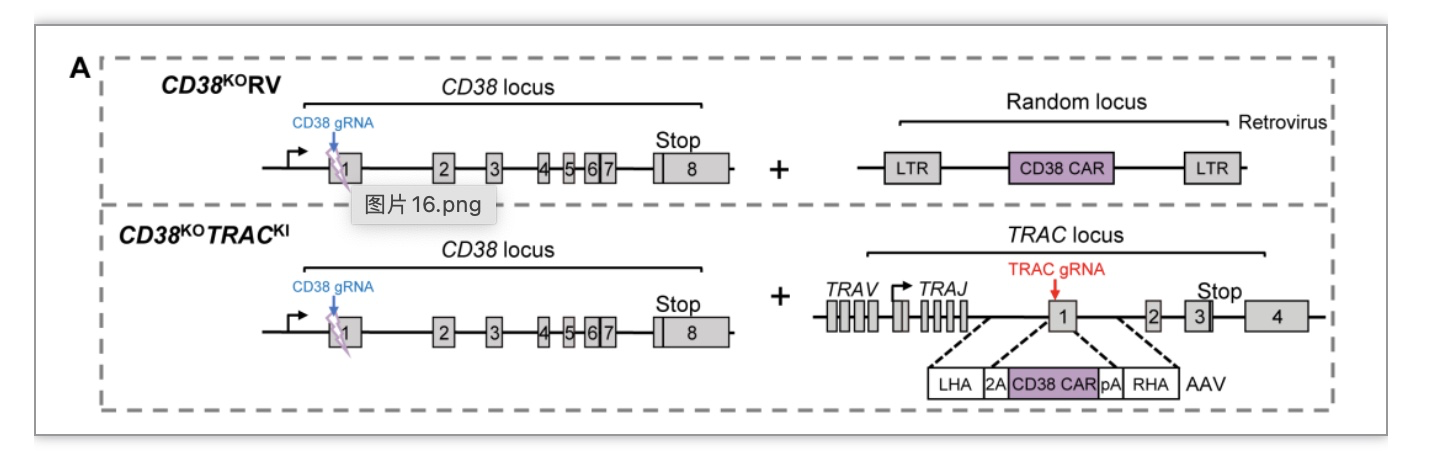
图2. CD38KOTRACKI和CD38KORV CAR-T细胞制备策略
由于制备CD38KOTRACKI CAR-T细胞需要两种gRNA,增加了脱靶风险和实验成本;此外,要同时敲除T细胞中的TRAC和CD38基因且达到较高的双敲效率需要更多的RNPs;而且CD38和TRAC基因双敲后的 T 细胞扩增效果不如 CD38基因单敲的 T 细胞。因此,作者设计了“二合一” 基因编辑策略,在敲除CD38基因的同时将CD38基因插入到CD38位点,同时为了控制CAR基因的表达,作者还设计了CD38 CAR基因分别在内源和外源启动子控制下表达的CAR-T细胞,分别为CD38KO/KI CAR-T(内源启动子控制)和CD38KO/IEF1α CAR-T细胞(外源启动子控制)。经体内外验证,三种CAR-T细胞在体外都能够清除T-ALL细胞系及原代T-ALL肿瘤,CD38KOTRACKI和CD38KO/KIEF1α CAR-T细胞表现出比CD38KO/KI CAR-T细胞更好的体内抗肿瘤活性。
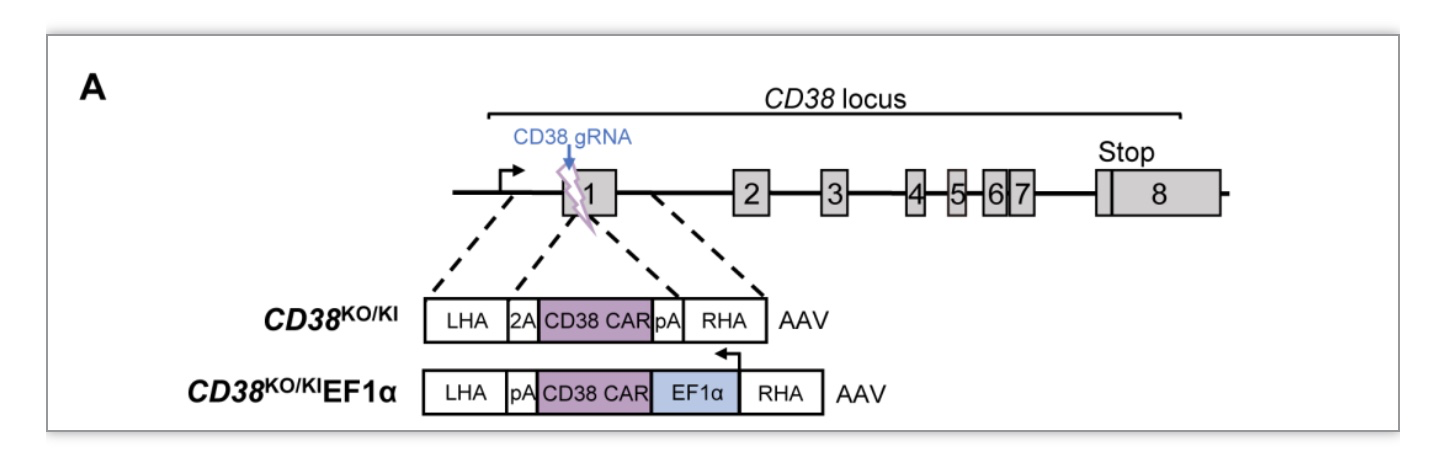
图3. CD38KO/KI CAR-T和CD38KO/KIEF1α CAR-T细胞制备策略
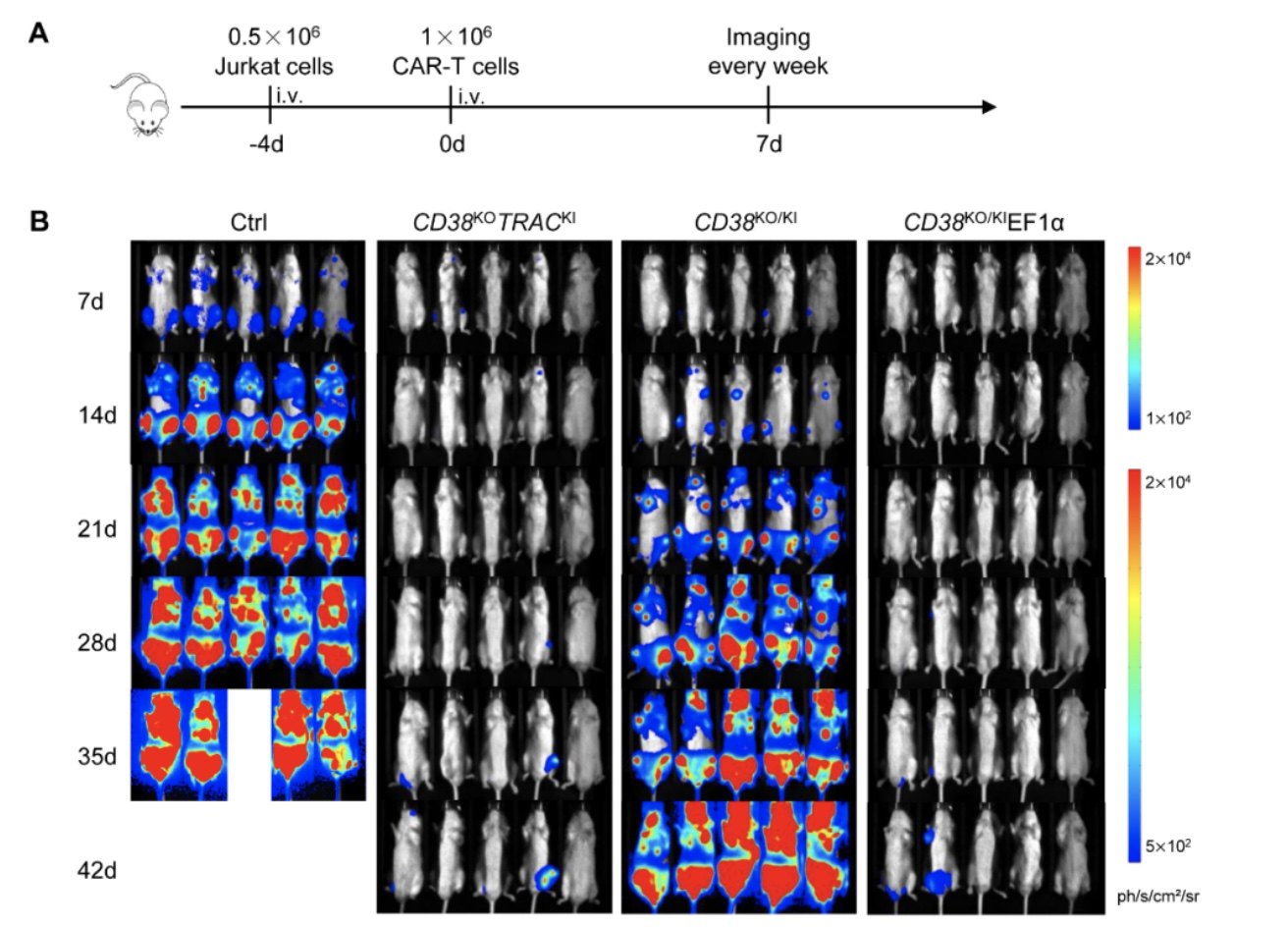
图4. 三种CAR-T细胞的体内抗肿瘤效果
由于CAR-T 细胞疗法治疗T细胞恶性肿瘤时需要将健康T细胞与恶性肿瘤T细胞区分开,但没有容易区分这两者的标记物,因此恶性T细胞可能被CAR改造,从而污染 CAR-T 细胞产品。用NK细胞代替T细胞治疗T-ALL则可以解决此问题,因此作者将“二合一”基因编辑策略应用于NK细胞制备了CD38KO/KI CAR-NK和CD38KO/KIEF1α CAR-NK细胞。有意思的是,CD38KO/KI CAR-NK细胞具有比CD38KO/KIEF1α CAR-NK细胞更好的体内抗肿瘤效果。进一步的探究发现,NK 细胞中的内源性调节原件导致 CD38 CAR 的表达高于T细胞,因此作者猜测,在T细胞中,CD38KO/KI CAR-T细胞中CAR的表达水平过低,受到抗原刺激后导致其不足以被活化,进而导致抗肿瘤效果不佳;在NK细胞中,CD38KO/KI CAR-NK细胞中CAR的表达水平较高,从而使其受到抗原刺激后充分活化,而CD38KO/KIEF1α CAR-NK细胞中CAR的表达水平过高,导致其受到抗原刺激活化后发生细胞凋亡(AICD),从而抗肿瘤效果不佳。
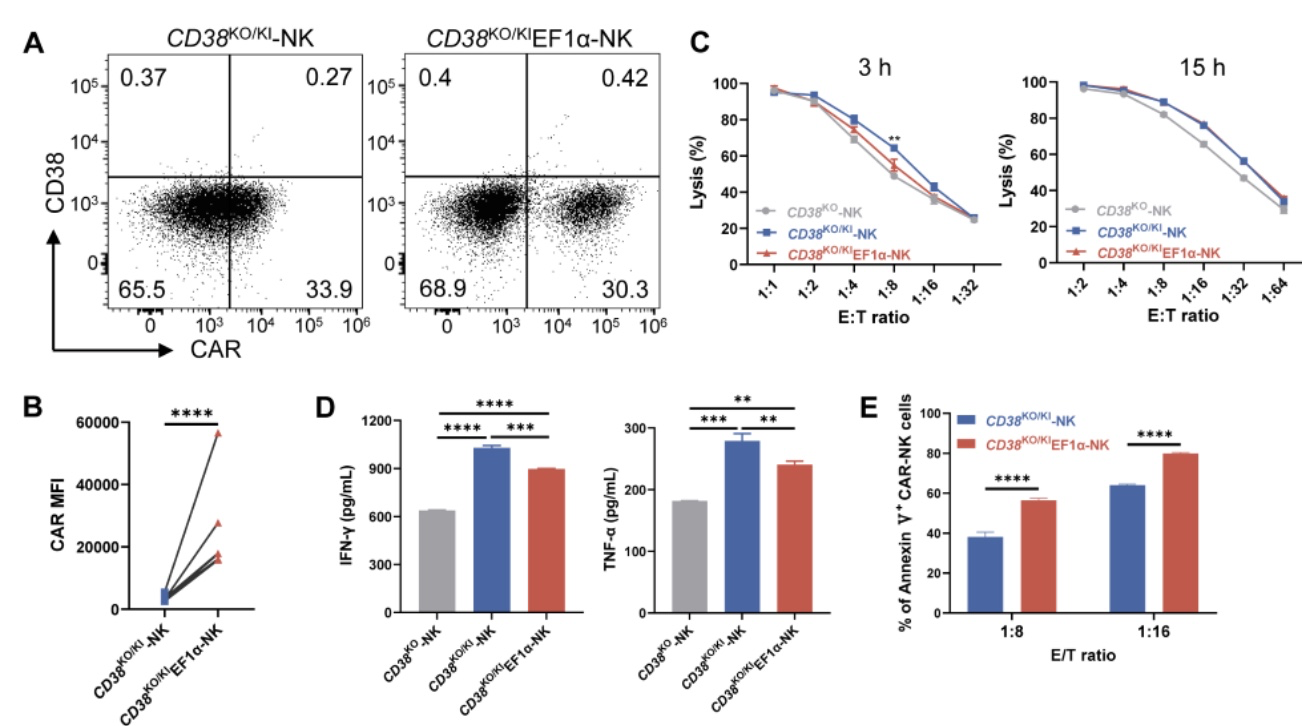
图5. CD38KO/KI CAR-NK 细胞在体外和体内表现出更好的抗肿瘤效果
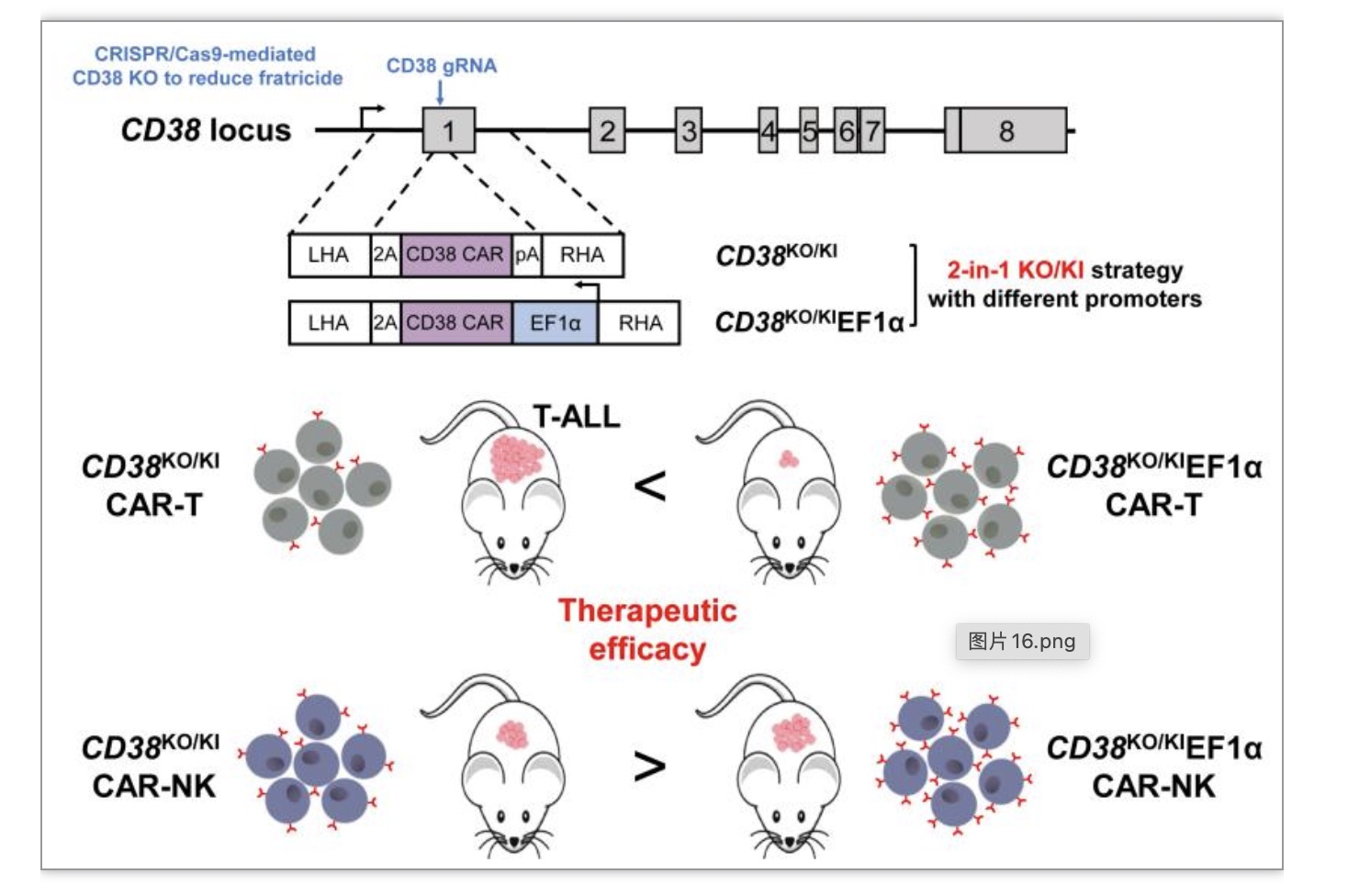
图6.模式图

