噬菌体是地球上数量最庞大的生物群体,是原核生物的病毒,对维持地球生态系统的有序运行意义重大。在噬菌体和宿主漫长的军备竞赛中,为抵御噬菌体的入侵,原核生物进化出了多种系统进行防御,例如限制修饰系统、CRISPR-Cas系统,以及近来不断涌现的多种引起流产感染的系统等[1]。其中,CRISPR-Cas系统是已知的唯一一种适应性免疫系统。相应的,噬菌体进化出了anti-CRISPR蛋白抑制Cas蛋白的切割,从而保持自身基因组完整。在已知的两大类六种类型CRISPR-Cas系统里,第二大类II型的Cas9效应蛋白已被广泛应用于基因编辑,具有简单、高效的优势。针对Cas9的anti-CRISPR蛋白也不断被鉴定。对于anti-CRISPR抑制机理的阐释,不仅可以增进人们对噬菌体与宿主间相互竞争关系的理解,而且有助于后续基因编辑工具的开发。
该研究揭示了一种噬菌体抵抗宿主防御的新颖机制:噬菌体anti-CRISPR蛋白AcrIIC4通过阻止完整R-loop结构的形成,达到抑制宿主Cas9监测复合物切割双链DNA活性的目的。

AcrIIC4由副流感嗜血杆菌(Haemophilus parainfluenzae, Hpa)的前噬菌体编码,对II-C型Cas9具有广谱抑制活性[2]。体外和体内实验均表明,AcrIIC4在基因编辑过程中能高效抑制Cas9的活性,具有被开发为基因编辑调控工具的潜力。然而,由于缺乏AcrIIC4和Cas9复合物的结构,AcrIIC4发挥抑制的精确机制还不明确。近期有两项工作说明AcrIIC4通过阻止DNA的结合来实现抑制[2, 3],还有一项工作提示AcrIIC4可能从空间上阻止核酸内切酶结构域HNH移动到切割位点附近,从而实现抑制[4]。因此,在AcrIIC4能否阻止DNA结合方面存在争议。针对上述科学问题,该研究首先解析了HpaCas9,AcrIIC4与向导RNA (sgRNA)结合的三元复合物的结构(图1),发现AcrIIC4结合到Cas9的两个识别结构域REC1和REC2之间,并与sgRNA建立了广泛相互作用。
接着,针对AcrIIC4是否阻止Cas9识别DNA的问题,研究人员成功体外重组了AcrIIC4和DNA同时结合到Cas9-sgRNA上的四元复合物,并利用冷冻电镜的手段解析了该四元复合物的结构。同时,还解析了在没有AcrIIC4存在的情况下,Cas9-sgRNA与DNA结合的三元复合物的晶体结构(图2)。比较两个结构,研究人员发现有AcrIIC4存在时,靶标链(TS)和sgRNA只能形成七个碱基的异源双链配对,R-loop不能完全形成;没有AcrIIC4存在时,二十四个碱基的异源双链配对能完全形成。因此,由于AcrIIC4的结合,R-loop的形成被阻断在中间步骤。
比较三种HpaCas9复合物的结构,作者发现主要差别是在REC2结构域的构象上(图3A)。在有AcrIIC4结合时,不管有无DNA存在,REC2结构域构象相近,DNA:RNA异源双链结合通道被阻断。而没有AcrIIC4结合时,REC2结构域呈外翻的构象,异源双链结合通道打开。由此可见,AcrIIC4的结合能够将REC1与REC2结构域绑定到一起,限制REC2的自由运动。
接着,研究人员通过生化实验手段检测REC2运动受限导致的影响。当双链DNA的靶标链和非靶标链(NTS)提前解链时,AcrIIC4不再能够完全抑制Cas9对dsDNA的切割(图3B),说明DNA两条链的配对对于AcrIIC4发挥抑制很重要,后者可能抑制双链解链。而且,凝胶迁移实验表明AcrIIC4能降低Cas9与DNA的结合,而对配对区为单链的DNA的结合无影响(图3C)。这一结合实验也佐证了AcrIIC4能抑制双链解链这一观点。进一步的实验证明,AcrIIC4能阻止双链DNA在PAM远端解链(图3D),并对TS-guide RNA结合通道的形成有负面影响(图3E),以此阻止完整R-loop的形成,终止后续别构激活。
此外,AcrIIC4对II-C型Cas9同源蛋白的抑制能力差异较大。该研究通过一级序列和三维结构比对,结合体外切割实验,发现两种Cas9的sgRNA在第一个茎环结构处的长度不同是导致这种差异的原因(图4A-C),这对在不同Cas9编辑系统中应用AcrIIC4具有指导意义。另外,在该工作中研究人员捕捉到了AcrIIC4的两种不同构象。静态光散射实验表明,AcrIIC4在水溶液中是单体。AcrIIC4具有的长螺旋能够发生弯折变成两段(图4D-E)。
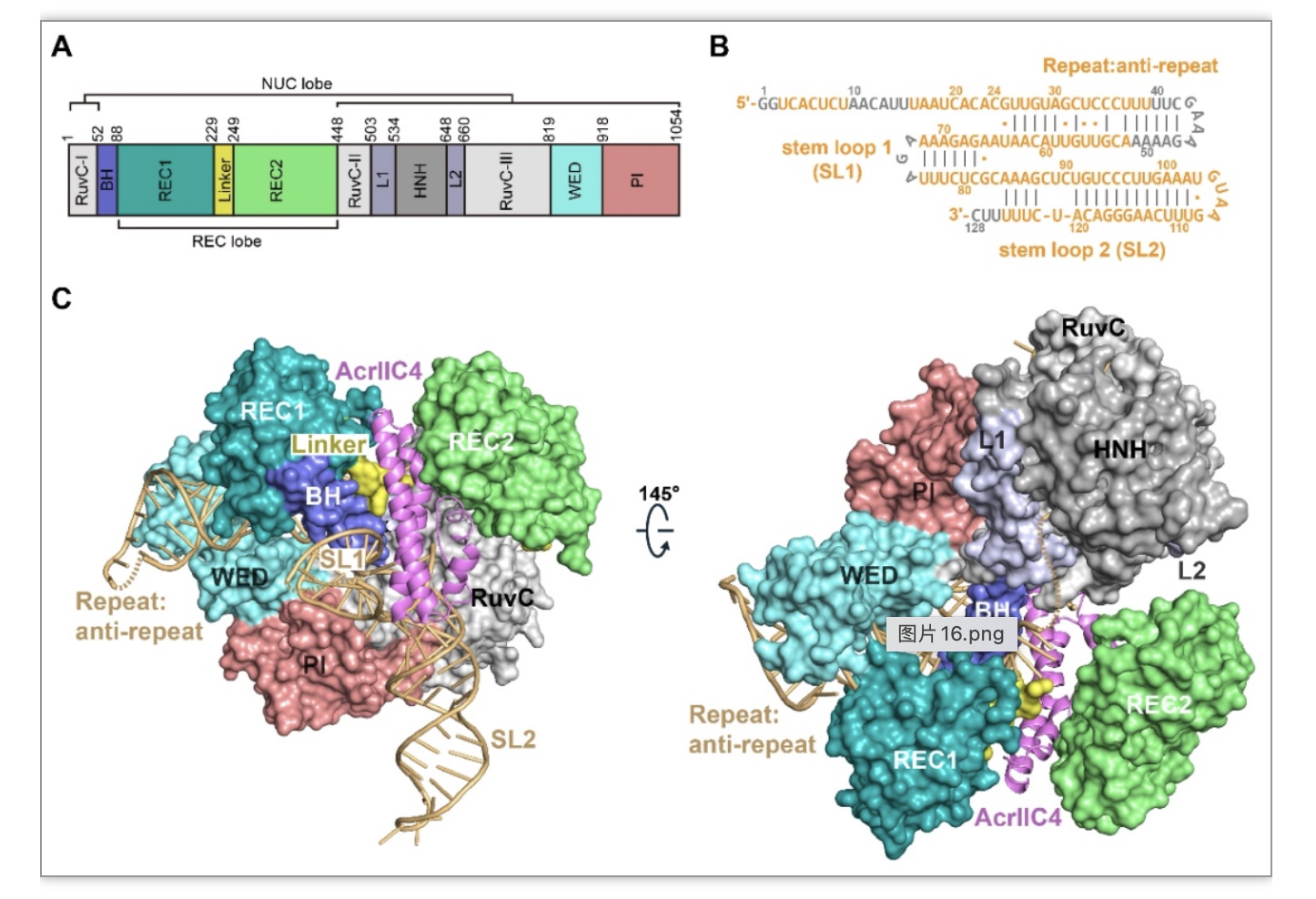
图1. HpaCas9-sgRNA-AcrIIC4三元复合物的结构
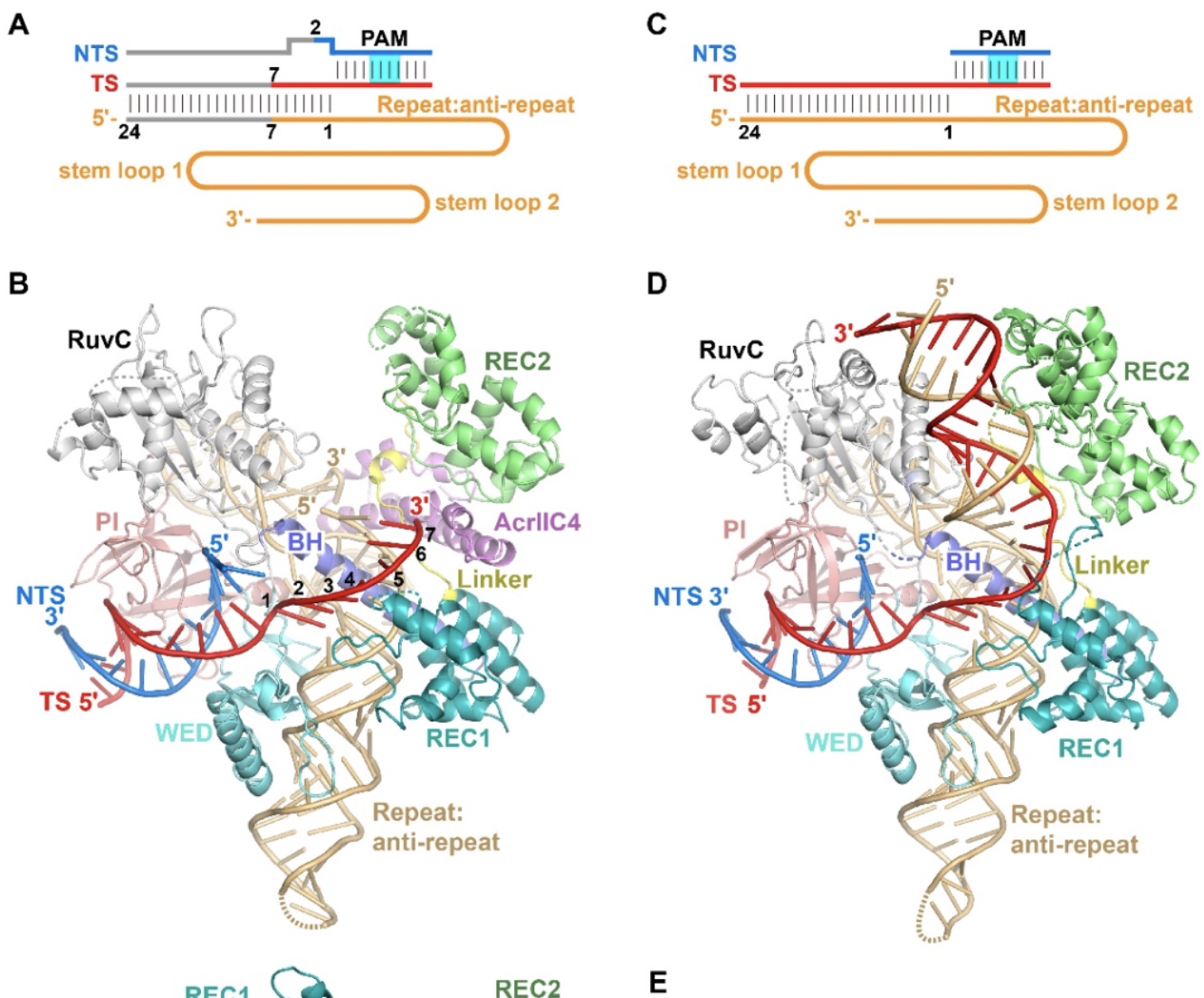
图2. HpaCas9-sgRNA-AcrIIC4-DNA四元复合物和HpaCas9-sgRNA-DNA三元复合物的结构
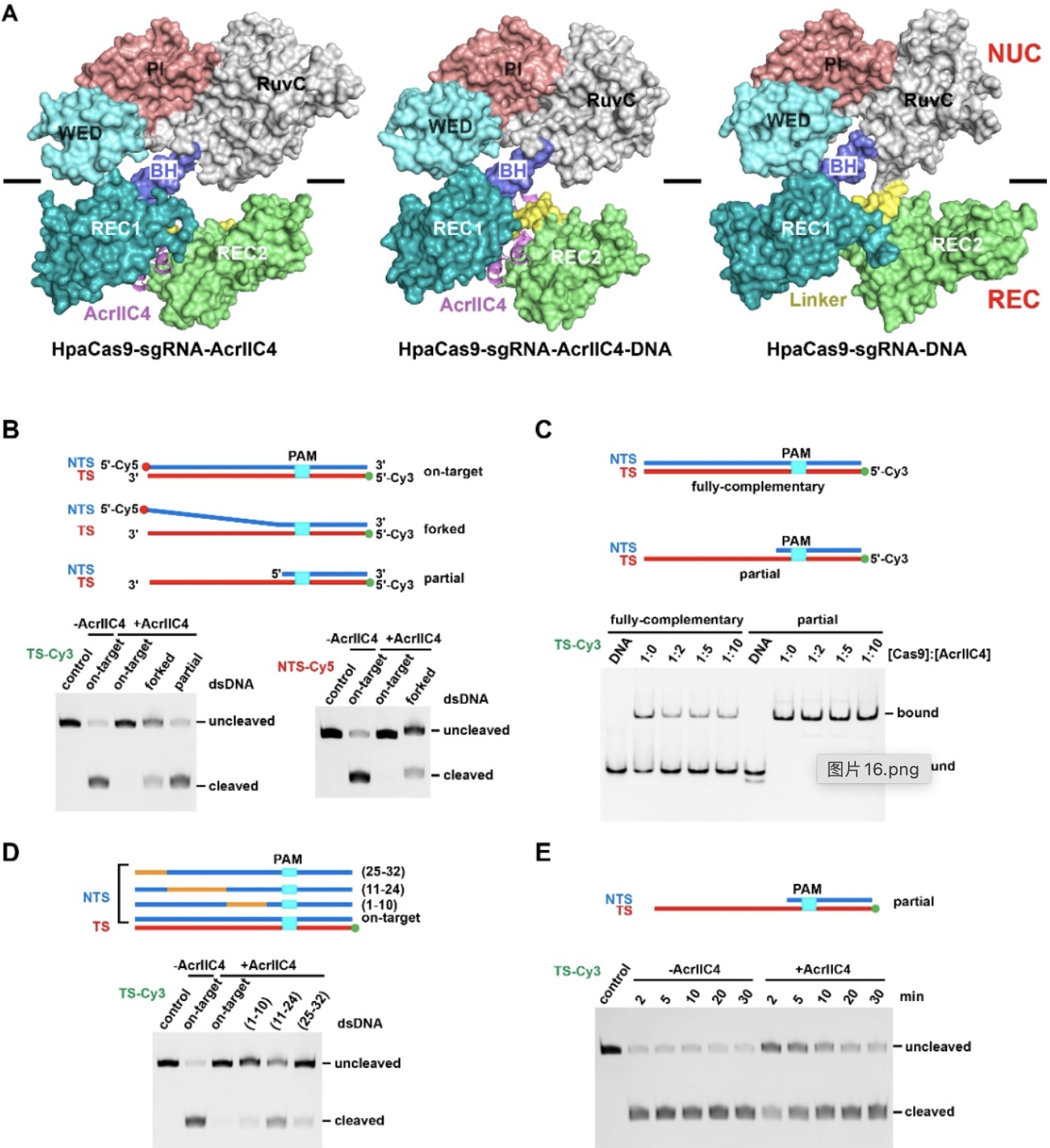
图3. AcrIIC4的抑制能力受双链DNA的靶标链和非靶标链部分提前解链的影响
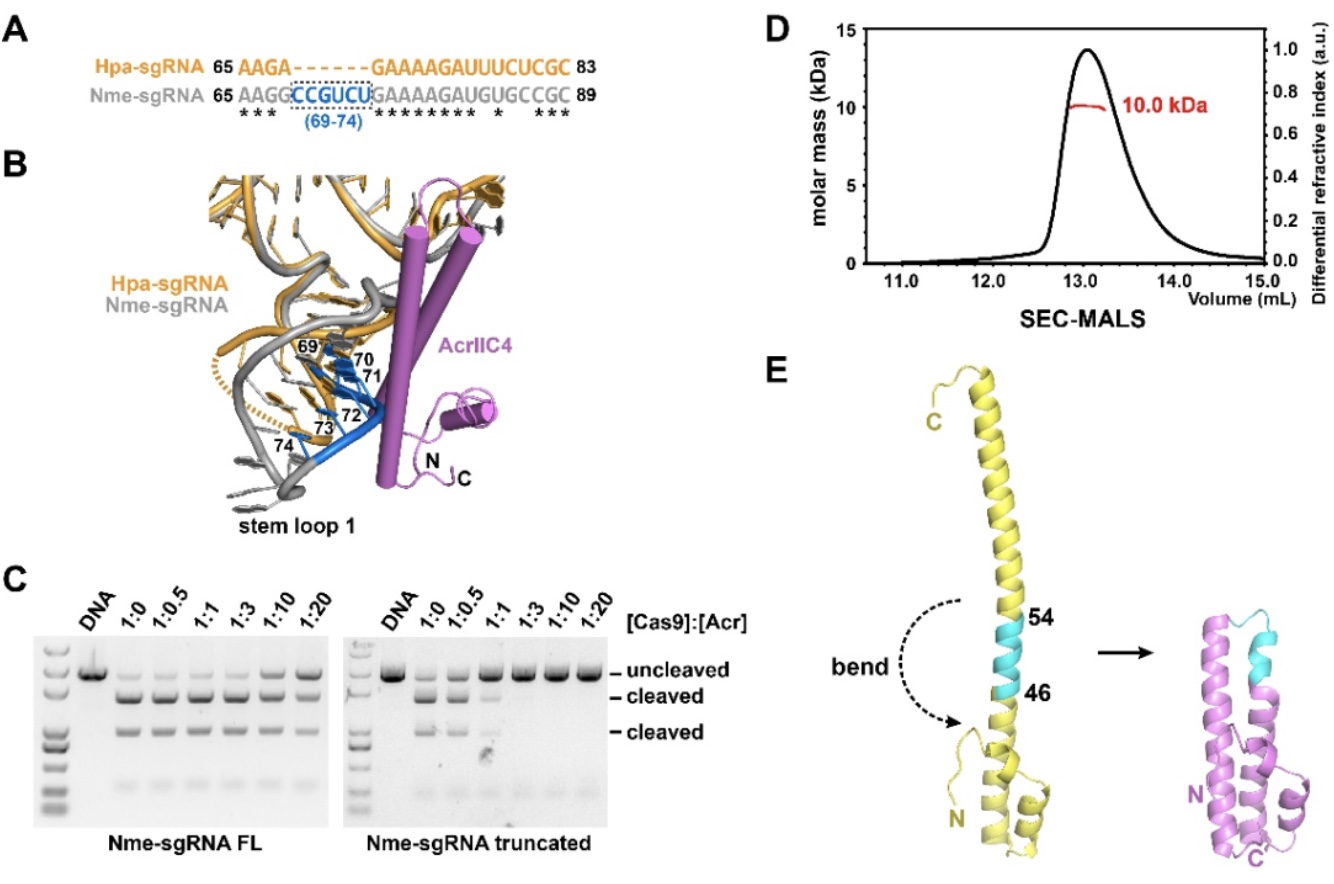
图4. SgRNA的长度不同影响AcrIIC4抑制能力及水溶液中AcrIIC4的聚集状态的探讨
生物物理所研究员在抑制机理的实验设计方面给予了重要指导。本研究得到了国家自然科学基金、中国科学院战略性先导科技专项(B类)和中国科学院青年创新促进会等项目资助。生物物理所生物成像中心和科学研究平台分别为电镜数据收集和静态光散射实验提供了技术支持。

