胃-食管部位发生的肿瘤具有极高的死亡率,每年会造成100多万的死亡人数,而其中的贲门癌在许多西方国家的发病率甚至增加了2.5倍以上,中国贲门癌的死亡率和发病率在各类恶性肿瘤中位居前列。胃食管交界处被称作贲门,而发生在该区域的肿瘤则被称作贲门癌。与其他胃食管区区域的癌症相比,贲门癌具有较强的侵袭性,且临床治疗多发生预后不良。因此,对其进行深入研究是十分重要的。
然而,可长期稳定传代的肿瘤相关模型的缺少对贲门癌的研究造成了阻碍。然而,在2022年5月11日,南加州大学林德晨团队等人在Science Translational Medicine发表题为“Generation and multiomic profiling of a TP53/CDKN2A double-knockout gastroesophageal junction organoid model”的文章。

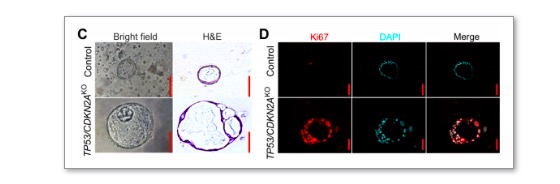
为了对贲门癌的相关机制进行研究,作者首先致力于研究模型的构建。而此前作者已成功通过分离的贲门组织构建出可稳定传代的贲门类器官。随后,在正常类器官的基础上,考虑到TP53和CDKN2A是贲门癌中最常发生突变的抑癌基因,作者使用CRISPR/Cas9技术对这两种基因进行敲除,并在克隆筛选与测序验证后表明病变模型的成功构建。而在培养过程中观察到的类器官体积增大,细胞结构改变,有丝分裂活性增加和明显增大的细胞核均进一步验证了贲门癌病变诱导的成功。
随后,类器官移植实验中在受体小鼠体内观察到的肿瘤发生也进一步验证了类器官的肿瘤性质。
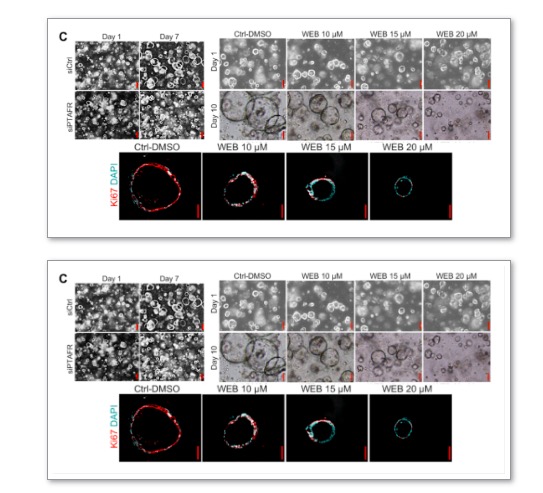
TP53与CDKN2A的敲除导致了正常类器官癌变的结果,然而,具体的病变机制尚不清晰。考虑到脂质代谢的失调是癌症发生的重要标志,作者从代谢水平出发,使用脂质组学MALDI成像质谱技术进行分析。凭借基因编辑类器官对贲门癌早期病变情况的高度模拟,作者在肿瘤与正常类器官的比对中成功筛查到变化最显著的脂质—血小板活化因子(PTAF)。
接下来,作者在转录组与表观基因组水平的分析发现了肿瘤类器官在RNA序列及DNA甲基化方面与正常类器官的显著差异。因此,为了检测出与贲门癌相关的转录因子,作者从差异甲基化区域中进行筛选,发现FOX家族在双敲除肿瘤类器官中低甲基化最显著的序列之一,而其中FOXM1与细胞增殖及细胞周期相关,是最有可能在其中发挥功能的转录因子。
而对PTAFR的启动子分析中也发现了FOXM1的高度富集,针对FOXM1进行RNA沉默后表现出与PTAF-PTAFR阻断后相同的表型,均进一步证明了FOXM1对PTAFR的正调控,以及对肿瘤类器官生长的促进作用。

