
本文中,作者通过上皮细胞与其基质细胞共培养来实现体外隐窝形成,同时维持增殖干细胞以及分化细胞。使用这种共培养的方式,成功构建出了结肠类器官组装体,证实了上皮细胞和基质细胞之间的相互作用能促进隐窝的形成。
为了研究上皮和基质之间的相互作用,作者首先致力于研究模型的构建。前期的研究发现简单地将原代基质细胞和上皮细胞共培养,并不能实现完美的体外模型,因为基质细胞倾向于从基质胶中迁移出来并粘附在板底。为了解决这个难题,作者先构建结肠类器官和正常培养基质细胞,再将预培养的基质细胞混合到基质胶液滴后立刻加入单个类器官。为了防止基质细胞的迁移,作者将培养物置于轨道振荡器生长。使用活细胞荧光成像,能够跟踪上皮和基质细胞于不同时空阶段的生长状态,在组合培养的第4天,类器官组装体便形成由紧密连接的基质层包围的隐窝状结构。同时由于基质细胞为体内的肠隐窝提供了重要的因子,作者猜想上皮隐窝的形成可以由基质细胞产生的因子单独诱导,于是在培养体系中去除了Wnt激活剂,CHIR-99021,R-spondin 1和BMP抑制剂Noggin,发现在缺少这些因子的条件下的类器官组装体和全培养基的类器官组装体结构相当,证实了作者的猜想,于是后期的培养体系均去除了这些因子。
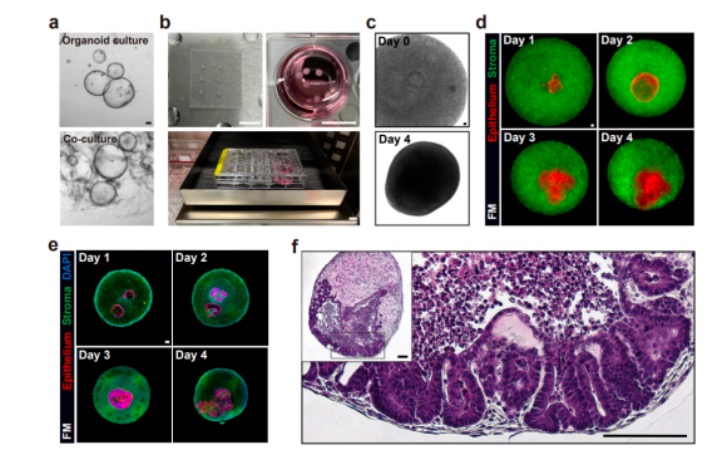
图1:类器官组装体的构建过程及其HE鉴定
为了证明类器官组装体和体内隐窝的相似性,作者通过化学诱导和免疫荧光染色等手段,首先发现了该模型在没有补充Wnt诱导因子的情况下,存在与体内类似的Wnt靶基因-AXIN1干细胞的分布;接着发现Yap相关蛋白的表达量会随着该模型的成熟逐渐降低,这与体内保持一致;最后通过免疫荧光图像和单细胞RNA测序等方式,发现类器官组装体有着与体内组织类似的细胞组成,比如存在许多看起来完全分化的杯状细胞和肠内分泌细胞等等,并且可以重现凋亡细胞向管腔排出的现象。
为了阐明结肠类器官组装体中基质细胞的多样性,作者通过免疫荧光染色首先发现维持CD31的内皮细胞、神经元细胞、成纤维细胞和肌成纤维细胞,这四种关键细胞类型的分布与结肠组织类似。接着作者针对类器官组合体中非上皮细胞进行RNA测序,发现了存在结肠组织中的特络细胞和滋养细胞。最后,作者使用单分子原位杂交评估了成纤维细胞群在类器官组装体中的空间分布,表明该组装体可以模拟体内结肠隐窝的上皮和间充质结构,能概括基质细胞(包括特络细胞和滋养细胞样细胞)的多样性和空间分布。
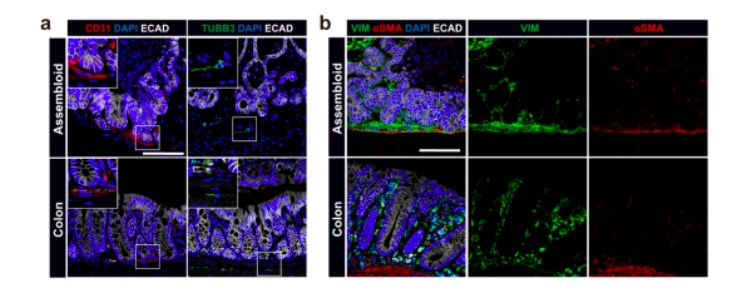
图2:类器官组装体的内皮细胞和神经元细胞的空间分布与结肠组织保持一致
由于特络细胞和滋养细胞表达对BMP信号传导作用相反,作者为了进一步鉴定模型中特络细胞和滋养细胞的功能,使用单分子原位杂交和Q-PCR等技术,发现类器官组装体的BMP激动剂-Bmp2主要在上皮细胞和基质细胞的隐窝顶部表达,逐渐向基部减少,而BMP抑制剂-Grem1表达在隐窝和基质细胞之间,这些蛋白的分布同样与结肠组织类似。
BMP是驱动胃肠道细胞分化的关键因素,为了探究该模型在研究上皮和基质之间信号传导的功能,作者通过两种基因敲除小鼠分别构建结肠类器官组合体,发现在BMP信号缺失的情况下,该模型仅是衬有上皮单层的简单球体,通过免疫荧光染色发现上皮细胞没有分化,而在BMP信号存在的情况下,结果相反。证实了BMP信号传导对上皮分化的关键作用。
在之前的工作中,作者发现在早期培养物中,BMP激活剂表达较低,不存在特络细胞,而BMP抑制剂在基质区域表达较高,随着隐窝的成熟,BMP激动剂在隐窝顶部表达增加,而BMP抑制剂却没有在隐窝和基质细胞之间表达,表明BMP信号传导与基质细胞组织之间存在潜在关系。为了验证上述观点,作者使用BMP处理过原代结肠基质细胞和滋养细胞后,通过Q-PCR,发现特络细胞标志物Foxl4和Wnt1a均显著增加,而滋养细胞标志物Cd5和Grem34下调,证实了基质细胞对BMP信号的响应,说明来自上皮的信号能决定基质细胞的空间分布。
最后,为了探究该模型在精准医学上的作用,作者在已成功诱导出小鼠结肠炎相关肿瘤的动物模型中,取出肿瘤组织,成功构建出结肠癌组装体,通过HE染色和免疫荧光染色,发现该组装体与类器官形态不同,组装体的细胞生长成不规则的脊,具有高增殖低分化的特点,类似于体内的肿瘤组织。作者还发现该组装体与肿瘤组织中YAP1的高表达,表示两者具有类似胎儿的更加原始状态。这些结果表明该类器官组装体能模拟结肠癌的形态特征,并用于研究肿瘤与其微环境之间的相互作用。

图3:肿瘤类器官组装体和原组织高度一致
总而言之,作者开创了一种上皮细胞和基质细胞共培养方式,可以研究胃肠道组织的细胞间通讯和自组织,上皮细胞和基质细胞之间相互作用的信号通路,同时由于该组装体在解剖学上比传统类器官更接近和更全面地类似于体内状态,这对胃肠道疾病的研究提供了更加优秀的模型,为相关肿瘤疾病的临床治疗提供了新的思路。

