2022年2月,由Katrin P. Guillen为第一作者,在《Nature cancer》杂志发表题为《A human breast cancer-derived xenograft and organoid platform for drug discovery and precision oncology》的文章。该团队工作提供了一大型临床相关的资源,用于配对体内和体外人源性乳腺癌模型,且这些模型可用于药物筛选和发现,该方法也有利于在临床护理下实时进行功能性精准医疗。为人类乳腺癌精准医学和药物开发提供了宝贵的方法和资源。
人类癌症的异质性限制了药物治疗的成功。人类患者来源的异种移植物(PDX)模型,即把人类肿瘤植入免疫缺陷小鼠体内并连续移植。无论是用于精确肿瘤学还是作为研究工具,PDX模型都受到高成本和低通量的限制。人类患者来源的类器官(PDOs)与其亲代肿瘤表现出很强的生物学保真度,包括一致的药物反应,并已被开发用于许多癌症类型。基因组检测正在成为个性化癌症治疗的主流。积累的数据表明,使用人类衍生模型的功能测试可能在单独的基因组学方面具有明显的优势。虽然药物反应通常与基因组发现相关,但在一半的病例中,尽管有相似的驱动突变但功能筛选发现了不同的药物反应。
许多关于乳腺癌的遗传和表观遗传学驱动因素正在被发现,主要的医疗需求——转移性乳腺癌中,分子的异质性是巨大的,且阻碍了成功的治疗方法的发展。数百种用于乳腺癌的PDX模型已经被构建。然而,仍然缺乏代表最致命乳腺癌的模型:耐药、转移性肿瘤、内分泌耐药雌激素受体阳性(ER+)和HER2+肿瘤。为了更好地了解不同乳腺癌亚型的治疗的敏感性和耐药性,有必要建立一个更大的晚期乳腺癌模型和体外这些肿瘤传播方法的生物样本库。
首先,作者团队构建了代表最大研究需求的乳腺癌类型——内分泌耐药肿瘤、ER+和HER2+共表达、异常侵袭性(例如化生)、耐药和原发转移或来自同一个体的纵向样本的PDX模型,总体“构建率”为29%。通过免疫组化(IHC)验证PDXs的乳腺上皮标记物和人线粒体为阳性,而小鼠和人淋巴瘤标记物CD45为阴性。ER、孕激素受体(PR)和HER2染色与原发肿瘤和/或临床病理报告一致。基因组学分析显示,PDXs最常见的变异是TP53和PIK3CA,团队收集的基因包含了所有常见的乳腺癌亚型。转移亚系保留了相同的基因组驱动突变。并与亲本PDX系具有相似的基因表达谱。(图1)
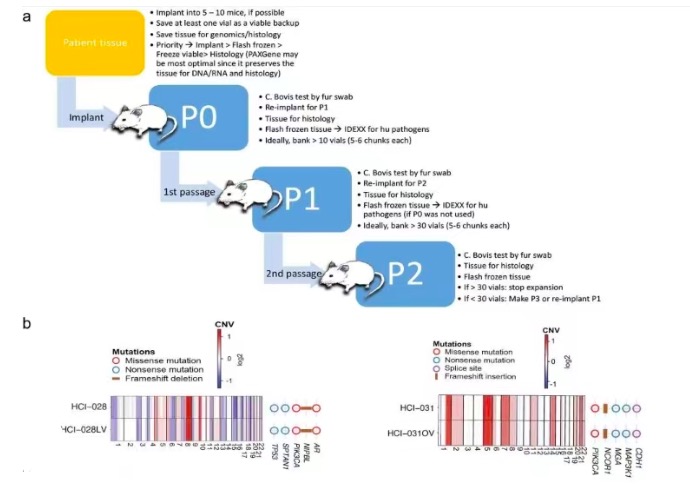
图1:PDX构建和基因组学分析
该团队建立并维持了所有标准的ER+ PDX系。通过尝试在没有雌二醇(E2)的去卵巢小鼠中培养已建立的PDX,来检测每个ER+ PDX的雌激素依赖性。转移性乳腺癌中的雌激素独立性被归因于ESR1的突变,它编码ERα。该团队采用滴式数字PCR(ddPCR)检测热点突变(Y537S/Y537C/Y537N和D538G)在ER+模型中ESR1的突变状态。来自7个个体的9个转移性ER+ PDXs中有5个含有ESR1突变。在两例人类样本中未检测到ESR1突变,但在匹配的PDX(DNA和RNA)样本中检测到<10%的Y537S突变的频率。在人类样本中,ESR1突变的异质性已被报道,在PDXs中也有类似的异质性。说明雌激素非依赖性的HCI-032亚系(HCI-032EI)的选择并没有导致任何ESR1突变。(图2)

图2:HCI-044 PDX 中Y537S纯合ESR018突变的ddPCR 结果
同时该团队优化了维持PDXOs长期生长的条件。作者团队以HCI-002作为测试模型,通过测量活细胞在孔中所占据的面积、类器官的形态和细胞内ATP的含量,测试在类器官培养中经常使用的添加剂,来评估PDXO的生长。该团队发现Rho激酶抑制剂(Y-27532)足以支持HCI-002 PDxOs在初始培养15d后的生长。为了确定ER+ PDXOs长期发展的额外需求,该团队使用HCI-011作为测试用例,在Y-27632存在的情况下,n-乙酰半胱氨酸(NAC)、油酸或碱性成纤维细胞生长因子的加入促进了HCI-011解离后的生长。因此得出结论,ER+ PDxOs的最佳培养基包括基础培养基加上碱性成纤维细胞生长因子和NAC。
随后该团队通过在常规的ER+ PDXO培养基中培养ER+ PDXOs,并将这些条件与含有木炭剥离胎牛血清(以去除E2)的培养基进行比较,检测了长期ER+ PDXO培养的雌激素反应性。发现E2也能刺激PDXOs的存活和生长。长期培养的三个代表性ER+ PDXO系作为PDXO异种移植物移植到小鼠后,对选择性ER降解物氟维司特有反应。这些数据表明,长期的ER+ PDXO培养在体内外维持功能性ER并保持内分泌敏感性。
即使是每种亚型最优的生长条件,一些PDXOs也很难建立。一旦每某个品系被证实是人类乳腺癌,没有小鼠细胞,并且可靠地可传代,则认为它就是被“构建”了。(图3)
图3:ER +和HER2 + PDxO培养物的优化
该团队对几个PDXO株系进行了深入的表征,以确定它们作为类器官长期繁殖后是否保留了原来的特性。通过苏木精和伊红(H&E)染色和IHC与人特异性波形蛋白、Ki67和人特异性细胞角蛋白8(CAM5.2)特异性抗体来评估类器官形态,发现不同培养时间后移植的PDXO与它们的来源的PDXs相似。
然后该团队对对早期和晚期传代匹配PDXs和PDXOs(11组ER+和TNBC模型)的模型进行进一步的基因组学分析,发现个体样本、PDX和PDXO模型之间的高度一致性。这些数据表明,总的来说,在人类肿瘤中观察到的主要突变驱动因素在不同传代的模型中保持不变。为了检验在体内和体外传代后的模型中是否发生了总CN变化,该团队使用单核苷酸多态性(SNP)阵列评估了早期和晚期传代模型与它们匹配的人类肿瘤,观察到,与来自不同个体的模型相比样本和他们的模型之间的高度相关性。这一结果支持了从人类样本到其模型的总CN保护。这些数据显示,与常用的细胞系相比,人类来源的模型更类似于它们的原始肿瘤。
随后,该团队开发了PDXOs的药物筛选方案,即将类器官接种384孔板,进行4天药物反应试验,使用GR50(模拟的半最大调节生长的浓度)和GRaoc(剂量-反应曲线上的面积)对类器官药物敏感性和细胞毒性做出评价。正如预期的那样,某些药物对特定的乳腺癌亚型表现出了选择性的作用。分析结果显示,细胞毒性化疗对TNBC细胞系的活性高于非TNBC细胞系,而PI3K、AKT和mTOR抑制剂在ER+和/或HER2+系中的活性高于TNBC。为了进一步研究PDXOs的药物反应与PDXs的反应反应如何,作者团队选择了在PDXO系中表现出非常独特的反应或耐药模式的药物。在7个PDX系上测试了比利那潘特,预测其敏感性范围。(图4)
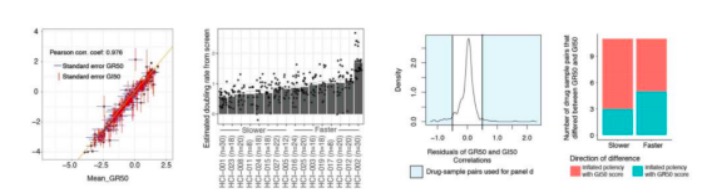
图4:使用GR50和GRaoc对类器官药物敏感性和细胞毒性做出评价
接下来,该团队研究了药物组合是否可以使用协同矩阵在PDXO培养中有效地测试药物组合。在体外卵巢癌细胞中,双利那帕坦与SN-38(前药伊立替康的活性代谢物)之间存在潜在的协同作用。分别和联合使用这两种药物,作者团队确定这种协同作用在乳腺癌PDXOs中也很明显。结果表明,PDXOs可以准确地预测PDXs中的药物反应,并可用于识别新的乳腺癌治疗方案。(图5)

图5:PDxO筛查时间表,包括临床病史,患者衍生模型建立,PDxO药物筛选和PDX反应的体内验证
最后为了说明PDXO药物筛查可以为临床护理提供信息,该团队介绍了一个43岁的IIA期TNBC患者的病例。该团队解冻了与之相对应的类器官,筛选了美国食品和药物管理局(FDA)批准的实验药物库,并在PDX模型上进行了全基因组测序和批量和单细胞RNA测序。两种FDA批准的乳腺癌药物,艾日布林和塔拉唑帕利,成为了很有希望的候选药物。通过三次剂量后停止治疗和动物肿瘤复发来测试对艾日布林反应的持久性。在所有小鼠中,单剂量艾日布林再治疗后没有复发或完全消退。将研究结果送回了诊所,患者服用艾日布林后,肝转移持续完全缓解近5个月,尽管患者的肝转移和腹水在艾日布林上完全消失。停用艾日布林,随后进行放射治疗。在停止全身治疗时,肝转移仍缓解了两个月。患者服用艾日布林后无进展生存期(PFS)和下一次系统治疗时间(TTNT)是之前治疗的PFS和TTNT的3.5倍和4.8倍。结果表明,PDXOs的功能药物测试是可行的,并可以在临床护理中实时提供有益的结果。

