生物发光成像(bioluminescence imaging)作为一种非侵入性(non-invasive)的活体成像技术,被广泛应用于对体内细胞活动和基因表达的实时追踪和监测,在癌症及感染性疾病等研究领域中具有重要作用。相较于常见的荧光成像,生物发光成像技术无需依赖激发光源,而单纯利用荧光素酶对底物的酶促作用所产生的能量进行发光,从而排除了自体荧光的干扰,在深层的动物组织中也保有很高的光信号灵敏度。
目前常用于活体成像的萤光素酶(又称荧光素酶,英文名luciferase)主要来源于昆虫或深海生物。这两类酶的底物结构和反应机理差异较大,原则上可用于对体内的双细胞群体进行实时监测。近些年随着蛋白工程技术的发展,不少新型的萤光素酶涌现出来,提供了更多更明亮的选择。例如,基于萤火虫萤光素酶(萤火虫荧光素酶,Firefly luciferase, FLuc)工程改造得到的AkaLuc,可以实现对小鼠的肺部内植入的单个细胞进行检测【1】。另一方面,深海生物类别的代表系统是NanoLuc®萤光素酶(NanoLuc®荧光素酶,NanoLuc® luciferase)及相应的化学改造底物Furimazine (Fz)【2】。在体外,表达NanoLuc®的细胞所产生的光信号甚至可以简单地通过手机拍摄探测到,远亮于传统的海肾萤光素酶(海肾荧光素酶,Renilla luciferase)。
尽管在体外NanoLuc®可以产生比FLuc高出100倍以上的光信号,但这两个系统在体内的表现却较为接近,这主要受限于底物Fz的物化和代谢性质。2020年7月13日,来自美国斯坦福大学医学院的Michael Z. Lin课题组与Promega Bioscience LLC的Thomas A. Kirkland研究团队合作(共同一作为苏一驰博士和Joel R. Walker)在Nature Methods杂志上发表了题为”Novel NanoLuc substrates enable bright two-population bioluminescence imaging in animals”的研究论文,报道了新型的NanoLuc®萤光素酶底物,为与NanoLuc®相关的体内成像提供了一套实用的底物递送方案,并联合AkaLuc荧光素酶系统,实现了在小鼠体内对肿瘤和CAR-T细胞同时进行追踪监测的应用展示。
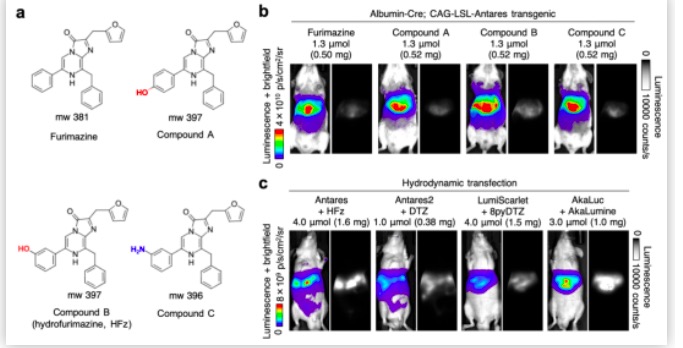
研究伊始,作者们认为Fz同时拥有苄基和苯基的化学结构具有较高的疏水性,很可能限制了Fz在水溶液中的溶解度和在体内的生物利用度(bioavailability)。NanoLuc®结合Fz的晶体结构表明Fz的苯基暴露在溶剂之中,是理想的修饰位点。因此,研究人员首先尝试将亲水性的羟基或氨基引入到Fz的苯环上。体外实验结果显示,苯环间位修饰的Fz衍生物的溶解度有显著的提升,且与Fz同样可被NanoLuc®高效利用,在光学性质上无明显差异。
接下来,研究人员尝试在体内对Fz衍生物进行表征。在过往的研究中,Lin课题组曾报道过一种可用青色光激发的橙色荧光蛋白CyOFP1,进而发现NanoLuc®与CyOFP1之间能高效地发生共振能量转移,使发射光大幅红移。在此基础上所发展出的Antares(CyOFP1-NanoLuc-CyOFP1融合蛋白)是一种新型萤光素酶,在体内具有更佳的组织穿透性和亮度【3】。如今,研究人员构建了能在特定器官组织内表达Antares报告基因的转基因小鼠,为体内筛选NanoLuc®底物提供了一个方便高效的平台。在转基因小鼠体内,苯环间位修饰羟基的Fz衍生物Hydroxyfurimazine (HFz)脱颖而出,可在安全剂量下产生近四倍于Fz的光信号峰值。另一种小鼠模型的建立则依靠尾静脉的流体动力学注射(hydrodynamic transfection),将编码萤光素酶的基因快速转入小鼠的肝脏进行表达。在此模型中,Antares/HFz发光系统的表现优于同类型的其他萤光素酶, 与Akaluc的信号表现也十分接近。
在对底物进行体内筛选的过程中,研究人员发现含有聚乙二醇-300(PEG-300)的有机-水混合溶剂可以有效地溶解Fz衍生物,但该制剂配方在大剂量注射时会对实验动物产生一定的毒性,不利于长时间对同一动物的反复实验。为了解决该问题,研究人员引入了一种常用于药物递送的增溶剂poloxamer-407(P-407)。为了验证HFz/P-407制剂的安全性,研究人员对连续用药三天的小鼠进行了病理组织学研究分析,在主要器官中并无发现明显的损害。而在Antares转基因小鼠体内进行的成像实验,则证明了同剂量HFz所产生的光信号峰值并不受这两类溶剂的影响。有趣的是,P-407还对HFz有一定的缓释作用,使得HFz/P-407制剂非常适用于跨度一小时以上的体内动态成像实验。
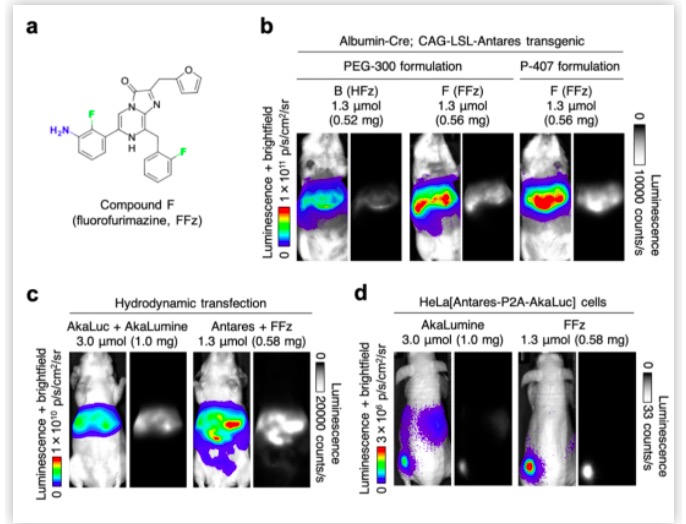
HFz的优良表现并未令研究人员停下对其他种类的化学修饰的探索脚步。氟元素在药物化学中有广泛的应用,对药物分子进行氟化修饰常常可以影响药物的药效强度、细胞膜透性和药物代谢动力学等性质。受此启发,作者们进一步对Fz的衍生物进行氟化修饰,并发现在苯环间位修饰氨基的Fz衍生物的基础上,通过引入两个氟原子修饰所得到的Fluorofurimazine (FFz),在体内的发光表现相较HFz有更进一步的提升。在几种不同的小鼠模型中,Antares搭配安全剂量的FFz甚至可以发出比AkaLuc更强的光信号【图2】。
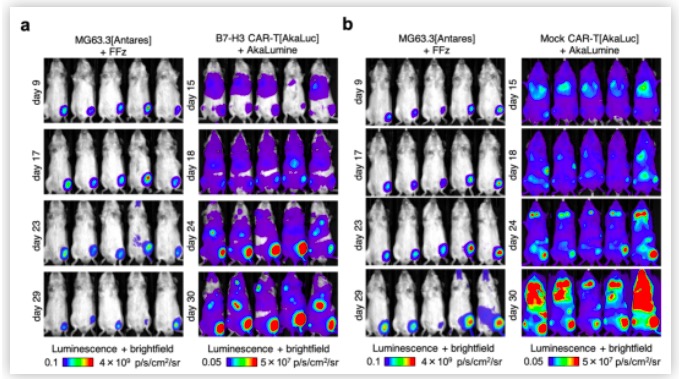
FFz的优异表现促使研究人员来构建双萤光素酶的高灵敏度体内成像系统。作者们首先将Antares报告基因转入到MG63.3人骨肉瘤细胞系中,进而在NSG免疫缺陷小鼠的腿部构建了MG63.3的肿瘤模型。于此同时,研究人员又建立了稳定表达AkaLuc报告基因的CAR-T细胞(靶向识别MG63.3癌细胞表面的B7-H3蛋白),并于肿瘤细胞接种后的第十四天通过静脉注射到小鼠体内。在接下来的两周内,作者们通过注射FFz对肿瘤生长进行监测,或者通过注射AkaLuc的底物对外源T细胞进行追踪。结果表明,虽然对照组的非特异性T细胞也有一部分能定位到植入的肿瘤部位,但并不能有效抑制MG63.3肿瘤的生长。与之相比,CAR-T细胞在肿瘤部位的定位特异性更强,且对肿瘤有明显的治疗效果【图3】。
在该研究中,作者们开发了新型的NanoLuc®萤光素酶底物,并展示了其在活体生物发光成像中的优越性能。值得一提的是,这一性能的提升并未涉及到对NanoLuc®萤光素酶的工程改造,因此这些新型的底物可以“即插即用”,简便地应用到各类表达NanoLuc相关报告基因的细胞系或小鼠之上,为提升信号强度提供了一种快速的解决方案。同时,借助新型底物,Antares可与AkaLuc构成高灵敏度的体内双萤光素酶报告系统,对研究动物体内双细胞群体间的相互作用具有十分重要的意义。
1. Iwano, S. et al. Single-cell bioluminescence imaging of deep tissue in freely moving animals. Science 359, 935–939 (2018).
2. Hall, M. P. et al. Engineered luciferase reporter from a deep sea shrimp utilizing a novel imidazopyrazinone substrate. ACS Chem. Biol. 7, 1848–1857 (2012).
3. Chu, J. et al. A bright cyan-excitable orange fluorescent protein facilitates dual-emission microscopy and enhances bioluminescence imaging in vivo. Nat. Biotechnol. 34, 760 (2016).