蛋白互作看起来很简单的实验,但是要选择什么方法,才能快、准、稳地完成?你是不是也常常遇到以下这样的问题?
❖
我有两个Tag的蛋白,怎么做?
❖
我有两个Tag free的蛋白,我有特异性的抗体,怎么做?
❖
我有两个Tag free的蛋白,没有抗体,怎么做?
不用担心,小U这就给你送上全方位的解决方案~
01
有两个Tag的蛋白,怎么做?
HTRF®是领先的TR-FRET(时间分辨荧光共振能量转移)技术。它结合了荧光的灵敏度与FRET(荧光共振能量转移)的同质性质和低时间分辨率的背景。HTRF使用两个荧光团,称为一个供体染料和一个受体染料,当它们相互接近时传递能量。供体源(例如闪光灯或激光)的激发触发向受体的能量转移,受体进而在给定波长发射特定的荧光。这种均相的体系中未结合的抗体不需要分离。受体的荧光发射只有在与供体接近时才能产生。
在HTRF蛋白-蛋白相互作用试验中,一个蛋白(直接或间接)与供体标记,另一个蛋白(直接或间接)与受体标记。当这两种蛋白质相互作用时,供体就会靠近受体。供体的激发将导致与蛋白质结合成正比的信号产生。

图1:HTRF原理和蛋白互作模型
优势
①均相,免洗,操作简单,全程1h;
②低背景;
③高通量,小型化(20μl),96、384孔和1536孔板均能获得稳定信号;
④稳定性高:信号稳定(反复读板,7天稳定),试剂稳定(无需避光);
⑤高灵活性:标记有Eu/Tb供体和标记有XL665/d2的受体,可以提供8种组合方式,非常灵活。

图2:HTRF技术蛋白互作实验流程
1.1
选择最佳的供体和受体对
我建议尝试所有受体对和供体对的组合,以获得最佳信号窗口的结果。以GST Tag HDM2和6His Tag p53蛋白为例:模型和初始抗体对设计如下图:
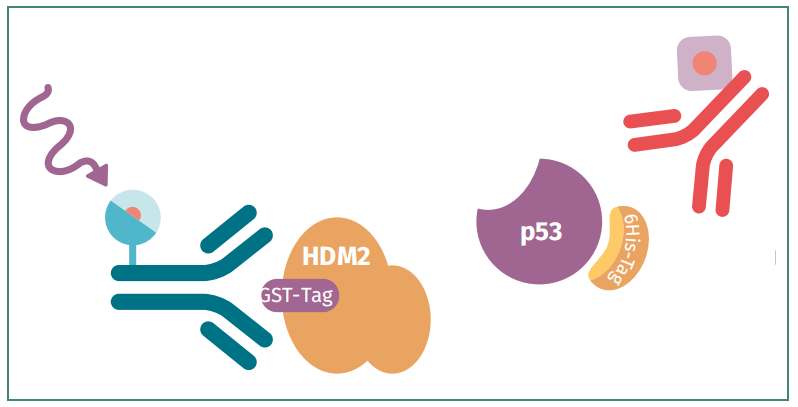
图3:GST Tag HDM2和6His Tag p53检测模型
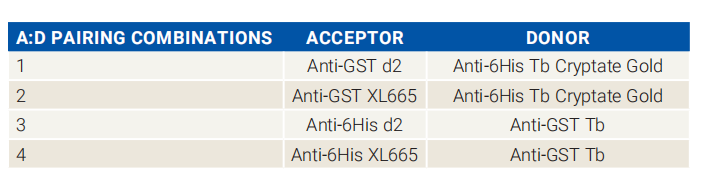
图4:供体和受体组合搭配参考
建议蛋白浓度做3个梯度,图5为布局参考。实验体系为20μl,HDM2和p53蛋白各5μl,检测抗体各5μl,按照图6所示操作。
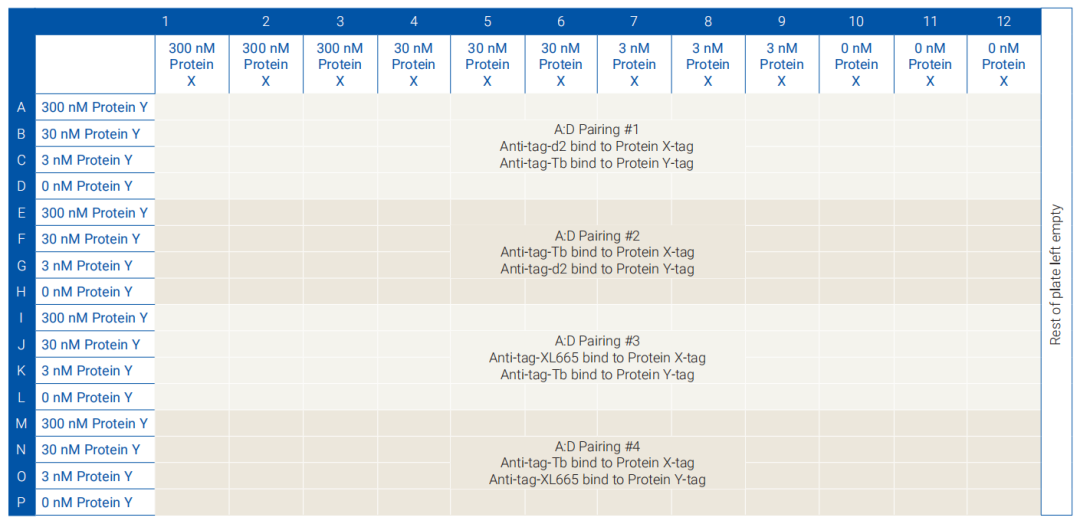
图5:梯度稀释布局示意

图6:实验流程
本次实验中,anti-6His Tb Gold作为供体和anti-GST d2为受体的组合可以获得最大信噪比可作为首选配对抗体。其次是anti-6His Tb Gold作为供体和anti-GST XL665作为备选。
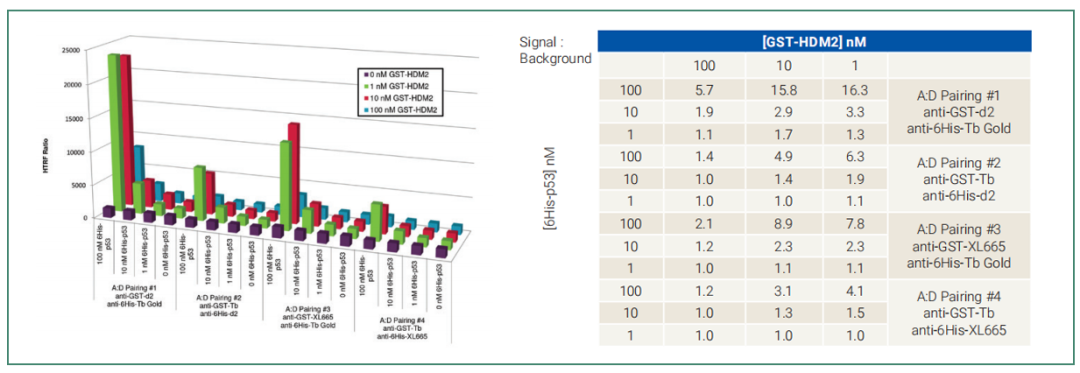
图7:anti-6His Tb Gold作为供体和anti-GST d2作为首选配对抗体
1.2
优化蛋白浓度
选择上述确定的标记抗体,对蛋白进行梯度检测,蛋白浓度可设置依次为:300nM,100nM,33nM,11nM,3.7nM,1.2nM和0.4nM。最佳浓度为100nM 6His-p53, 33nM GST-HDM2。

图8:蛋白浓度数据
那么,抗体浓度呢?若上述实验中所得的信噪比满足实验需求,可不做抗体对优化,如有更高的需求,可参考图9进行抗体浓度的确定。

图9:抗体优化参考
根据以上实验得到相应的数据为,本次实验可选择anti-6His Tb Gold作为供体和anti-GST d2作为受体,蛋白浓度分别是100nM 6His-p53, 33nM GST-HDM2。接下来,就可以继续化合物的筛选工作啦!!!
02
有两个Tag free的蛋白,
有特异性的抗体,怎么做?
我有蛋白,但是蛋白没有标签?也没有生物素化?可以用HTRF技术吗?
当然可以 !
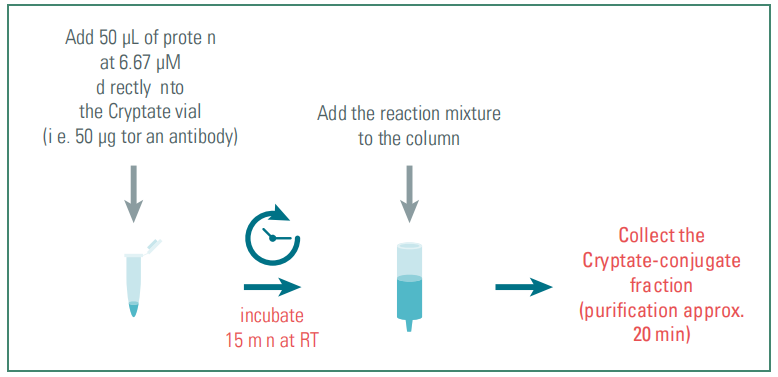
图10:标记流程简述
我们有标记试剂盒,可以将荧光供体Eu或Tb,荧光受体d2标记到抗体或者蛋白上哦~全程仅需1小时,非常nice...
来源于优宁维药物研发官网

