导读
靶向蛋白质降解 (Targeted protein degradation,TPD) 是一项药物利用细胞自身的泛素蛋白酶体系统(Ubiquitin–Proteasome System,UPS)或溶酶体靶向降解目标蛋白质的技术,按具体作用原理又可细分为近10种不同的技术路线。其中,蛋白水解靶向嵌合体 (PROteolysis TArgeting Chimeria, PROTAC)已成为药物研发中发展最快且最具优势和市场的蛋白降解技术路径。相比传统小分子抑制剂,PROTAC可让非药物靶点(undruggable)转变为可行药物靶点(druggable)的“实力碾压”,使之成为新一代“重磅疗法”。
PROTAC简介
蛋白水解靶向嵌合体 (PROteolysis TArgeting Chimeria, PROTAC)的概念由Craig Crews教授及合作者于2001年在PNAS上首次提出。近20年来,PROTAC发展迅猛,自2019年PROTAC领军者Arvinas公司的PROTAC药物ARV-110、ARV-471进入临床I期,PROTAC的研发热度持续上涨,截至2022年7月,共10多种PROTAC药物进入临床,170多种处于临床前阶段。PROTAC是一个具有双功能的分子,是一种利用细胞自身泛素蛋白酶系系统对靶蛋白进行降解的药物开发技术。其结构由三部分组成: 靶蛋白配体,E3泛素连接酶配体,以及中间连接这两部分配体的linker,如下图1所示:

图1
PROTAC作用机制
PROTAC通过同时招募靶蛋白和E3泛素连接酶,从而形成靶蛋白-PROTAC-E3泛素连接酶的三元复合物,使靶蛋白被E3连接酶泛素化。被泛素化的蛋白可以被细胞内的蛋白酶体特异性识别并降解,与此同时PROTAC被释放重新参与循环,如图2所示:
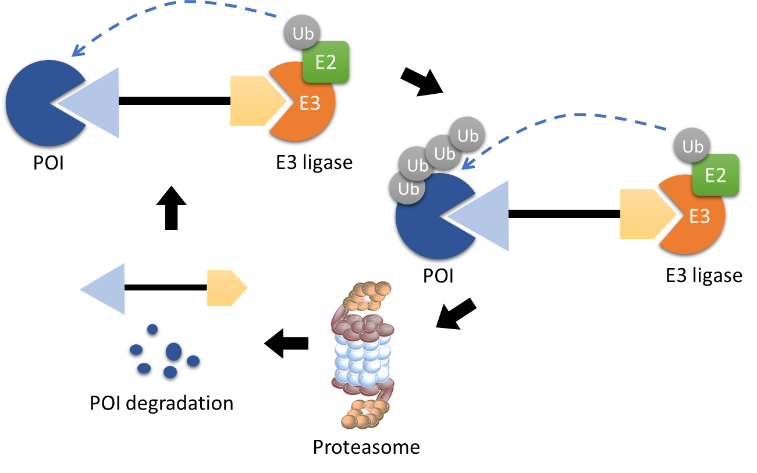
图2
PROTAC优势分析
区别于传统小分子抑制剂的“占据驱动”机制,PROTAC的作用机制为“事件驱动” (图3)。简单来说,小分子抑制剂通过持续占据靶蛋白的活性位点来阻断蛋白功能,从而实现抑制效果。而PROTAC与靶蛋白的结合不像小分子一样依赖于占据蛋白的 “结合口袋” ,而是结合在靶蛋白的任意一处,理论上都可以实现靶蛋白降解而非抑制蛋白功能。除此之外,当靶蛋白发生突变可能会影响小分子与靶蛋白的结合从而失去抑制效果,从而产出对突变体的耐药性。但这些突变并不会影响到PROTAC与靶蛋白的结合。因此,对于一些难成药的蛋白靶点(表面光滑无结合口袋、结合口袋浅、易发生突变),PROTAC无疑是更好的成药策略。
PROTAC的 “事件驱动” 以及利用泛素蛋白酶体系统降解蛋白等机制,使它具有:
|
1 |
能靶向传统难以成药蛋白靶点; |
|
2 |
克服耐药性; |
|
3 |
用量小,活性高; |
|
4 |
高选择性,低毒性等多项优势。 |

在PROTAC的作用过程中,靶蛋白-PROTAC-E3连接酶三元复合物的形成是靶蛋白能否成功被降解的关键。以KRAS-G12C突变体(靶蛋白)和VHL(E3连接酶)为例,可以利用HTRF均相技术评价三元复合物的形成情况(图4&5)。使用Eu荧光基团标记的Anti-Tag1抗体和XL665标记的Anti-Tag2抗体分别检测两种蛋白,当KRAS-G12C蛋白和VHL被PROTAC分子招募并形成三元复合物时,供体Eu和受体XL665也因此拉近,此时在特定波长的激发下,供体Eu会向受体XL665产生能量转移(FRET),使XL665受体产生特定波长的发射光,通过检测FRET信号来反映三元复合物的形成情况。
LC-2是首创的基于VHL的内源性KRAS G12C的 PROTAC降解剂,HTRF检测结果可以清楚表现出LC-2的三元复合物的形成能力以及药物适用浓度范围,完整呈现了LC-2的 “Hook Effect”曲线。
来源于优宁维药物研发官网

