经过基因编辑的细胞疗法为癌症的治疗带来了新的希望。最常见的细胞疗法是利用表达嵌合抗原受体(CAR)的 T 细胞 CAR-T。
尽管 CAR-T 药物的发现和开发进展迅速,但生物制药行业仍然需要学习如何以商业上可行的方式制备细胞治疗药物,以满足监管安全和质量标准。其中 CAR-T 药物的商业化进程需关注 CAR 基因如何在 T 细胞中表达的问题。
研究者们构建了复制缺陷型的重组慢病毒载体(LVV),使 CAR 基因能在 T 细胞中长期稳定表达,而不能进行病毒的自主复制。由于 LVV 可感染分裂和非分裂期细胞,外源 DNA 可整合到宿主细胞基因组中稳定遗传,并且具有良好的安全性,因此,被广泛地用于细胞治疗领域。有报道称,GMP 级别的 LVV 生产成本约占 CAR-T 细胞治疗药物生产成本的 30%。因此,开发能规模化生产 LVV 的上下游工艺对于降低 CAR-T 细胞治疗药物的价格至关重要。本文就 LVV 的生产展开讨论。

图1 慢病毒感染宿主细胞机制示意图
赛默飞生物工艺 LVV 生产解决方案可帮助提高载体上游包装滴度,优化下游纯化工艺路线,缩短用于质量检测的分析方法开发时间,帮助降低 LVV 生产成本。
LVV 上游细胞培养
LVV 生产工艺可分为上游病毒包装和下游病毒纯化两个主要阶段(图 2)。病毒载体的上游是指产生病毒载体的步骤,这是通过将 DNA 转移到用作载体工厂的包装细胞中实现的。

图2 LVV 生产工艺示意图。
在工艺开发阶段,病毒载体的包装通常在 2D 细胞培养中完成,并放大到用于临床和商业生产的生物反应器中进行生产。使用的细胞是永生化细胞系,最常见的是人胚肾细胞系 HEK293T。
由于目前大规模生物反应器仅适用于悬浮细胞培养,但是 HEK293T 是一种贴壁细胞系,因此面临着大规模生产的挑战。目前一些适应贴壁细胞培养的反应器培养方案,例如填充床生物反应器,有望成为解决贴壁细胞放大难的有效方案。此外,还可通过将贴壁的 HEK293T 细胞驯化为悬浮细胞,解决 LVV 难以规模化生产的问题。
病毒载体的包装从生产细胞系(例如 HEK293T 细胞)的扩增开始,然后用质粒 DNA (pDNA) 转染细胞以转移慢病毒颗粒生产所需的基因。病毒载体颗粒成熟后,从生产细胞膜出芽并释放到细胞培养基中,收获细胞培养上清液即可得到 LVV。因此,区别于其他无包膜载体(例如腺相关病毒 (AAV) 载体),慢病毒载体不需要细胞裂解步骤来释放病毒颗粒。
针对 LVV 的上游细胞培养阶段,不论是贴壁工艺还是悬浮工艺,赛默飞均有相应的解决方案供选择(图 3)。
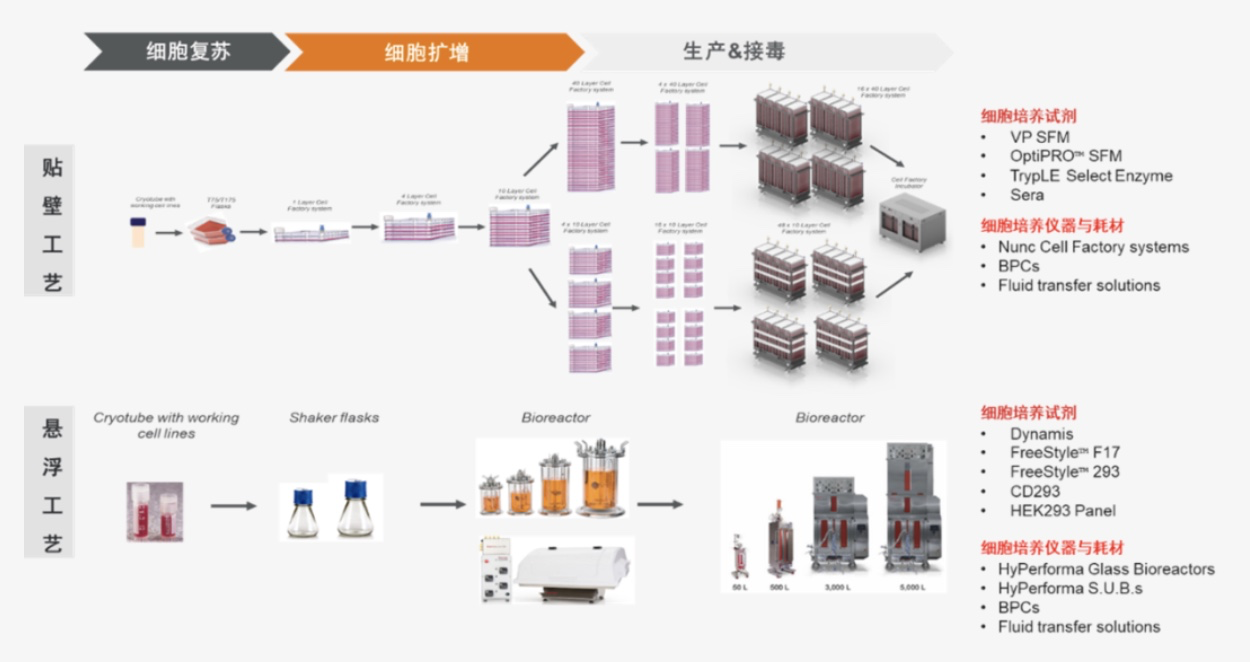
图3 赛默飞生物工艺 LVV 上游细胞培养工艺
LVV 下游纯化
LVV 的下游纯化始于细胞培养上清液的收获。LVV 收获液高度异质化,含有大量工艺和产品相关杂质。常见工艺路线如图 4 所示。
-
澄清步骤是为了去除聚集体和细胞碎片等大杂质,可以通过离心或过滤的方式实现。为了降低后续纯化的难度,该步骤可利用核酸酶消化以切割大片段核酸。
-
捕获步骤旨在保留和浓缩慢病毒载体,并进一步去除与工艺和产品相关的杂质。可以添加中间纯化步骤以置换缓冲液、浓缩产品或去除特定杂质。
-
通过精纯步骤以去除剩余的杂质,这些杂质通常难以从终产品中分离出来,因为它们的理化特性与 LVV 高度相似。捕获和精纯步骤都可以通过下游处理技术的多种组合来实现,这些技术可能包括超速离心、超滤/渗滤 (UF/DF)、切向流过滤 (TFF)、层析等。
-
灌装制剂步骤可能包括缓冲液置换、无菌过滤、冷冻保存或赋形剂添加等。
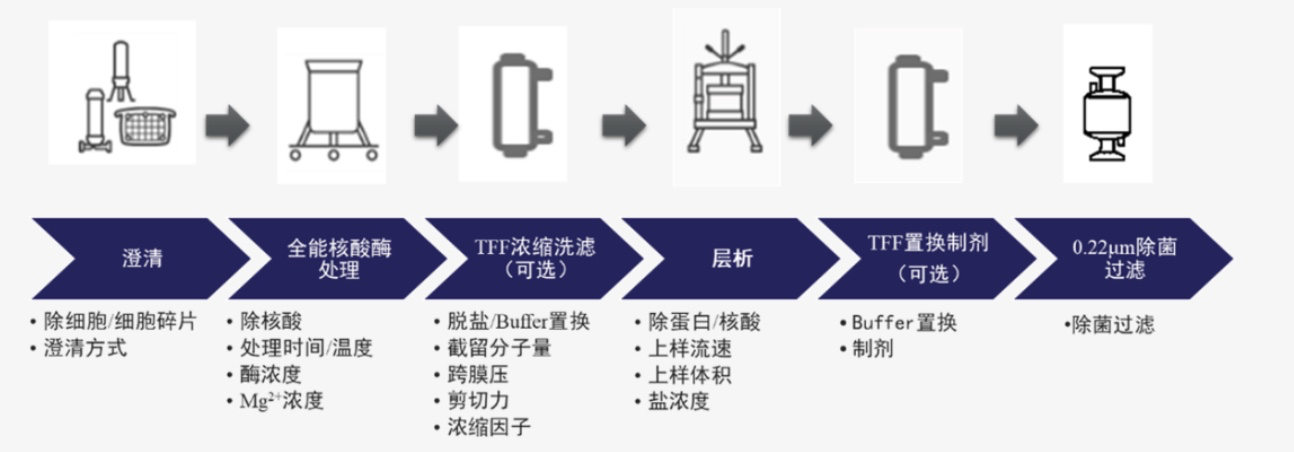
图4 LVV 下游纯化工艺路线示意图
由于慢病毒颗粒极易失活,因此,在进行 LVV 纯化时,应考虑简化下游纯化工艺路线,以减少纯化过程中的病毒载体损失,提高回收率。CaptureSelect 慢病毒 VSVG 亲和填料经过专门设计,专用于纯化 VSV-G 假型慢病毒颗粒,结合容量为 1x1011 总颗粒数/mL填料。洗脱条件温和,有助于保持包膜病毒颗粒的感染活性。如图 5 所示,LVV 收获液经全能核酸酶处理和澄清过滤后,利用 CaptureSelect 慢病毒 VSVG 亲和填料纯化,经测试,LVV 的活性滴度回收率可达 50% 以上。

图5 CaptureSelect 慢病毒 VSVG 亲和填料纯化工艺路线图(左)和图谱(右)
LVV 质量检测
GMP 级别 LVV 的关键质量属性(CQA)涉及多个检测项目,包含外观、理化、杂质、无菌等多个方面。表 1 是目前行业内对 LVV 关键质量属性进行检测的常用方法和标准。其中,qPCR 技术是应用得较为广泛的检测技术,可用于多个指标的检测。赛默飞可提供多个基于 qPCR 技术的检测试剂盒,可用于慢病毒物理滴度、感染滴度、HEK293 细胞残留DNA、质粒 DNA 残留、支原体的检测。
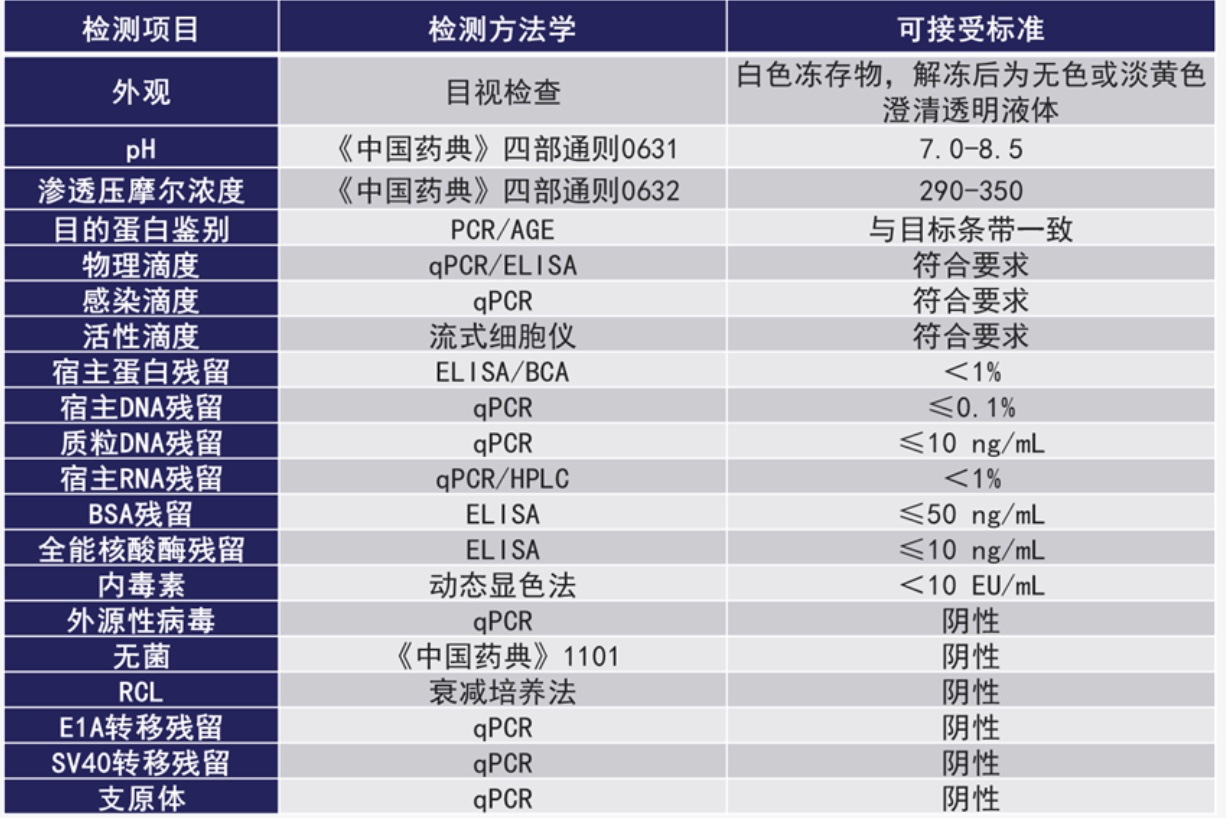
表 1 LVV 的关键质量属性(CQA)
LVV 生产常见问题 Q&A
Q1
在传统的 LVV 生产过程中有哪些关键环节?
合成感兴趣基因(GOI)并将其引入转移质粒是生产 LVV 过程中的关键步骤。为提高使用 LVV 的安全性,可通过将合成慢病毒载体的必须元件构建到不同的质粒上,降低可复制性慢病毒生成的风险。经过多年的研究,LVV 载体的生产步骤已较为完善,有可参考的方法进行 LVV 生产。然而,GOI 长度的增加给功能性病毒载体的生产带来了新的挑战,GOI 长度的增加通常导致病毒滴度降低。下游工艺的开发和优化对于减少纯化过程中的病毒损失至关重要。LVV 是脆弱的包膜病毒,一旦从宿主细胞中出芽,它们就完全成熟并具有功能。然而,LVV 对流速、剪切力、pH 值、温度、缓冲液等因素等极其敏感。因此,复杂的纯化过程极易导致 LVV 丧失感染活性。
Q2
LVV 是通过贴壁细胞还是悬浮细胞进行生产呢?
贴壁细胞和悬浮细胞都是常用的生产“工厂”,但悬浮培养可实现更高的 LVV 滴度,因为可以使用更大的生物反应器,但悬浮培养需要特别强大的下游纯化工艺,以去除悬浮液中存在的所有工艺相关杂质和产品相关杂质。对于贴壁细胞培养,可利用中间换液的方式减少收获液中质粒、转染试剂、细胞碎片等杂质,而悬浮细胞培养无法通过这种方式进行杂质去除。
Q3
LVV 生产过程中使用的原材料对细胞的毒性大吗?
原材料对生产细胞的细胞毒性不是特别大,但随着病毒的产生,生产细胞会裂解,裂解残留物和释放的胞内物质会对新病毒颗粒产生毒性问题,导致新病毒颗粒活性丧失。同时,细胞的裂解将导致下游纯化难度增加。因此,在进行 LVV 生产时必须综合考虑病毒生产和细胞培养两个方面,在维持细胞活率的同时,保证病毒的生产和活性维持。
Q4
如何减轻与 LVV 不稳定性相关的下游挑战?
在所有纯化步骤中,进行过程中采样对于确定可能发生病毒损失的步骤,以及为每个纯化步骤建立关键工艺参数(CPP),确定终产品关键质量属性(CQA)来说至关重要。一般来说,下游纯化方法对大多数 LVV 都适用,但需要评估可能对 LVV 稳定性和完整性产生影响的因素,以获得具备最大感染滴度的 LVV。
针对慢病毒载体的生产,赛默飞持续致力于全新技术平台的开发,革新生产工艺,可提供端到端的整体解决方案。
参考文献
1.Brian Gazaille, Joseph B. Lillegard, Robert A. Kaiser, January McKee, Michael J. Maurer, Natalia Elizalde and Katie Pollock. Cell Therapy — Lessons Learned from Working with Vectors and Cells. BioProcess International. 2023 Jan 31. Ebook.
2.Huang Z, Dewanjee S, Chakraborty P, Jha NK, Dey A, Gangopadhyay M, Chen XY, Wang J, Jha SK. CAR T cells: engineered immune cells to treat brain cancers and beyond. Mol Cancer. 2023 Jan 31;22(1):22. https://doi.org/10.1186/s12943-022-01712-8.
3.Labbé, R.P.; Vessillier, S.; Rafiq, Q.A. Lentiviral Vectors for T Cell Engineering: Clinical Applications, Bioprocessing and Future Perspectives. Viruses 2021, 13, 1528. https://doi.org/10.3390/v13081528.

