案例从静态细胞培养板到摇摆式生物反应器采用了 CTS OpTmizer T 细胞扩增 SFM (无酚红) 进行培养,确定该培养基扩增 T 细胞的效果与含血清培养基相同。
培养基
培养基1:CTS OpTmizer T 细胞扩增 SFM (无酚红),补充了 2 mM 左旋谷氨酰胺和 2.5% 的含 CTS OpTmizer T 细胞扩增添加剂;4 mM Gibco™ CTS™ GlutaMAX™-I 添加剂和 2.5% 的 CTS™ 免疫细胞血清替代品 (ICSR)。
培养基2:另一供应商的基础培养基,补充了 5% 的人 AB 血清 (hAB)(Gemini 生物制品)和 2 mM Gibco™ 左旋谷氨酰胺 (Thermo Fisher Scientific)。
接种
G-REX™ 容器 (Wilson Wolf Manufacturing) :将 5x106 个 T 细胞接种在了 100 mL 的指定培养基中;
静态板(Fisher Scientific)和 PermaLife™袋 (OriGen Biomedical):将 T 细胞按 1x106 个细胞/mL 的浓度接种在了指定培养基中。
激活和刺激
在所有实验中,均使用Gibco™Dynabeads™ Human T-Expander CD3/CD28 (Thermo Fisher Scientific) 以每个 T 细胞 3 个磁珠的比率激活 T 细胞,静态培养板和 G-Rex 容器中的实验使用 100 IU/mL 的 rIL-2,培养袋中的实验使用 300 IU/mL 的 rIL-2。
静置培养
静态培养板和培养袋实验:T 细胞浓度保持在 5 x 105 个细胞/mL,并在第 3、5、7 和 10 天使用 Vi-CELL TM 分析仪 (Beckman Coulter) 计数
G-Rex 容器实验:在第 5 天和第 7 天更换培养基。
在所有条件下,均在第 3、5 和 7 天使用 100 IU/mL 的 rIL-2 补充培养物。
摇摆式生物反应器培养
按照说明在 0-3 天内激活静态 PermaLife 袋中的细胞。第 3 天,将细胞接种到 Thermo Scientific™ HyPerforma™ 摇杆式生物反应器上的 10 L Thermo Scientific™ 摇摆式生物反应器 (BPC) 中。将细胞以 0.25 x 106 个细胞/mL 的密度接种到含有 100 IU/mL 的 rIL-2 的 1,500 mL 指定扩增培养基中。活细胞密度在第 5 天和第 7 天维持在 0.25 x 106个细胞/mL,直至达到 5 L 的最大体积(rIL-2 随培养基添加)。使用自动气体控制将溶解氧保持在 22%,并通过自动添加碱将 pH 保持在 7 或以上。在整个运行过程中根据培养物的重量自动调整搅拌速度和摇杆角度。每天监测细胞生长和活性,并在第 10 天用流式细胞仪评估表型。
流式细胞术
在第 10 天,通过用以下 Invitrogen™ 抗体对 T 细胞进行染色评估了细胞表型:
Pacific Orange™ CD3、FITC CD4、Pacific Blue™ CD8、eBioscience™ APC CD62L 和 eBioscience™ PE CCR7 (Thermo Fisher Scientific)。
1
CTS OpTmizer SFM(无酚红)能够有效地扩增静态培养板中的 T 细胞
传统方法中,最常见的 T 细胞扩增和哺乳动物细胞培养容器是静态培养板或烧瓶。图 1 提供的证据表明,CTS OpTmizer T 细胞扩增 SFM(无酚红)(补充了 CTS ICSR 和 CTS GlutaMAX-I 添加剂)与来自另一供应商的含血清培养基(图1A)相比,在静态培养皿中可促进更高水平的细胞生长。此外,所得到的细胞表现出理想的表型,其特征是 CD8+ 细胞与 CD4+ 细胞的比率保持不变(图1B)、有大量的中央记忆细胞和缺乏终末分化细胞,这是通过对 CD3+ 群体中 CD62L 和 CCR7 表达进行测量所得(图1C)。
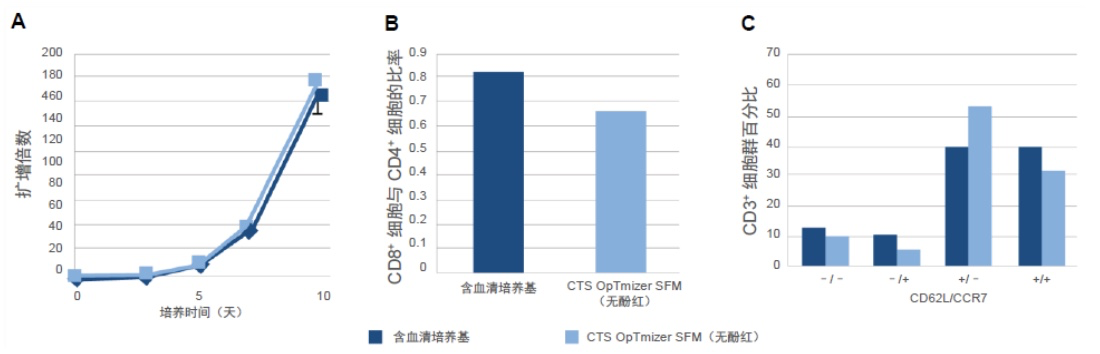
图 1.静态板中的 T 细胞扩增。在 CTS OpTmizer T 细胞扩增 SFM(无酚红)的静置细胞培养板中对 T 细胞进行了 10 天的培养。(A) 随时间推移测量细胞生长,并以扩增倍数形式进行报告(误差条是每个数据集的标准差)。在第 10 天进行表型鉴定以确定 (B) CD8+ 细胞与 CD4+ 细胞的比率和 (C) 分化程度,这通过 CD3+ 细胞群内的 CD62L 和 CCR7 表达进行测量所得。 这些调查以另一家供应商含 5% hAB 的基础培养基为基准。数据代表三个实验重复项的平均值。
2
CTS OpTmizer SFM(无酚红)能够有效地对静态培养袋中的 T 细胞进行扩增
另一种传统的 T 细胞培养容器是静态袋。使用 CTS OpTmizer T 细胞扩增 SFM(无酚红)(补充了 CTS ICSR 和 CTS GlutaMAX-I 添加剂)在袋中进行的 T 细胞扩增与含血清培养方法的结果同样相似(图2A)。两种培养基的 CD8+ 细胞与 CD4+ 细胞的比率(图2B)和分化状态(图2C)也彼此相当。CD8+ 和 CD4+ 细胞的密度均合格,并且细胞朝向分化光谱中央记忆端的分布也适当。
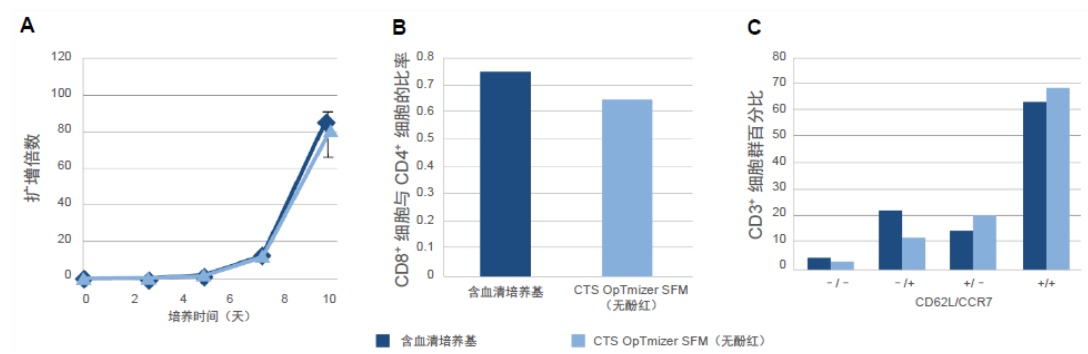
图 2.静态培养袋中的 T 细胞扩增。在 CTS OpTmizer T 细胞扩增 SFM(无酚红)的静置细胞培养袋中对 T 细胞进行了 10 天的培养。(A) 随时间推移测量细胞生长,并以扩增倍数形式进行报告(误差条是每个数据集的标准差)。在第 10 天进行表型鉴定以确定 (B) CD8+ 细胞与 CD4+ 细胞的比率和 (C) 分化程度,这通过 CD3⁺ 细胞群内的 CD62L 和 CCR7 表达进行测量所得。这些调查以另一家供应商含 5% hAB 的基础培养基为基准。数据代表三个实验重复项的平均值。
3
CTS OpTmizer SFM(无酚红)能够有效地扩增 G-Rex 容器中的 T 细胞
G-Rex(透气型快速扩增)培养平台已经成为T 细胞扩增首选的静态容器。在 G-Rex 平台上测试了 CTS OpTmizer T 细胞扩增 SFM(无酚红)(使用 CTS ICSR 和 CTS GlutaMAX-I 添加剂进行了补充)的使用,发现它对 T 细胞生长的支持最高可达到与含血清培养基相同的水平(图3A),产生的细胞群表现出预期的 CD8+ 细胞与 CD4+ 细胞比率(图3B),并且与中央记忆表型相关的标记物具有高表达(图3C)。
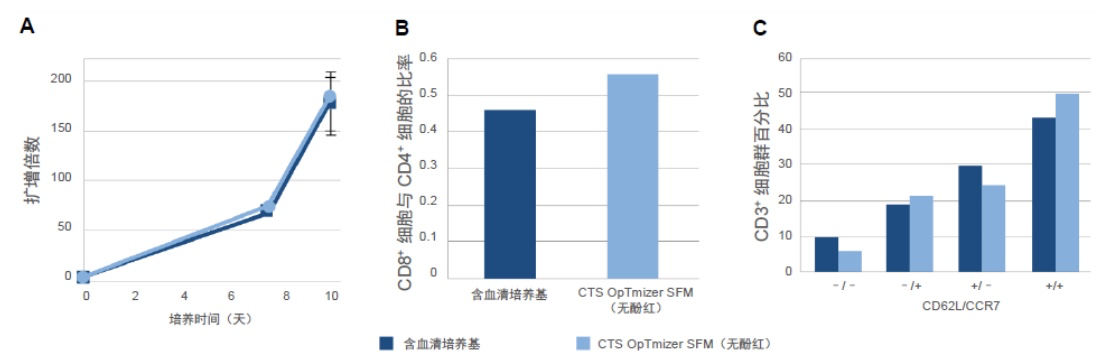
图3.G-Rex 容器中的 T 细胞扩增。在 CTS OpTmizer T 细胞扩增 SFM(无酚红)的 6 孔 G-Rex 培养容器中对 T 细胞进行了 10 天的培养。(A) 随时间推移测量细胞生长,并以扩增倍数形式进行报告(误差条是每个数据集的标准差)。在第 10 天进行表型鉴定以确定 (B) CD8+ 细胞与 CD4+ 细胞的比率和 (C) 分化程度,这通过 CD3⁺ 细胞群内的 CD62L 和 CCR7 表达进行测量所得。这些调查以另一家供应商含 5% hAB 的基础培养基为基准。数据代表三个实验重复项的平均值。
4
CTS OpTmizer SFM(无酚红)能够有效地扩增自动摇摆式生物反应器中的 T 细胞
HyPerforma 摇摆式生物反应器是一种大容量摇摆式生物反应器,能够自动控制气体处理、补料和 pH 值维持。同样,CTS OpTmizer T 细胞扩增 SFM(无酚红)(使用 CTS ICSR 和 CTS GlutaMAX-I 添加剂进行了补充)扩增细胞的效率与含血清培养基相同(图4A)。此外,这些细胞显示的 CD8+ 细胞与 CD4+ 细胞比率与含血清培养基的比率相似(图4B),并且表现出分化标记物的理想分布,其突出特征是效应细胞水平很低(图4C)。
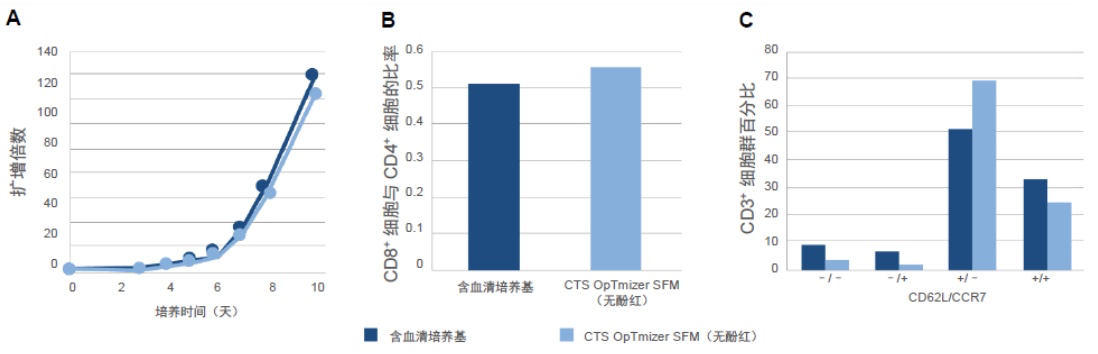
图 4.HyPerforma 摇杆式生物反应器中的 T 细胞扩增。在 PermaLife 静态袋中进行 3 天激活后,在 HyPerforma 摇杆式生物反应器上的 CTS OpTmizer T 细胞扩增 SFM(无酚红)中对 T 细胞进行了培养。DO 和 pH 分别保持在 25% 和 ≥7.00。(A) 随时间推移测量细胞生长情况,并以扩增倍数形式进行了报告。(B) 在第 10 天进行表型鉴定以确定 CD8+ 细胞与 CD4+ 细胞的比率和 (C) 分化程度,这通过 CD3⁺ 细胞群内的 CD62L 和 CCR7 表达进行测量所得。这些调查以另一家供应商含 5% hAB 的基础培养基为基准。
CTS OpTmizer T 细胞扩增 SFM(无酚红)支持在采用不同工作流程的各种培养容器中进行 T 细胞扩增,包括静态培养板、静态培养袋、G-Rex 容器和摇摆式生物反应器。扩增产生的细胞群保持了可接受的 CD8+ 细胞与 CD4+ 细胞比率,并且这些细胞群的特征始终是表达中央记忆标记物的细胞水平较高,表现出终末分化表型的细胞数量很少。

