外泌体
是由细胞分泌于细胞间质中的一类直径为 (30-150 nm) 的细胞外囊泡。外泌体具有的磷脂双分子膜结构使其可以在不影响机体其他生理状态的情况下,稳定地携带和转移包括细胞通信、免疫调节、血管生成、肿瘤发生和转移等事件的重要生物信号(除了蛋白、DNA之外,外泌体内的RNA也是研究的热点,主要包括mRNA和miRNA)(Li et al., 2019;Tenchov et al., 2022) 。这样的生物学特性可以为相关疾病的诊断和治疗提供重要的参考,同时可以作为药物的递送载体,因此外泌体相关研究引起了越来越广泛的关注(图2)。
图1:(a) 细胞内外泌体的产生路径 (b) 外泌体的内容物可能作为疾病的生物标志物,这里图示出一些已知的外泌体生物标志物。除了蛋白质,外泌体还含有多种核酸
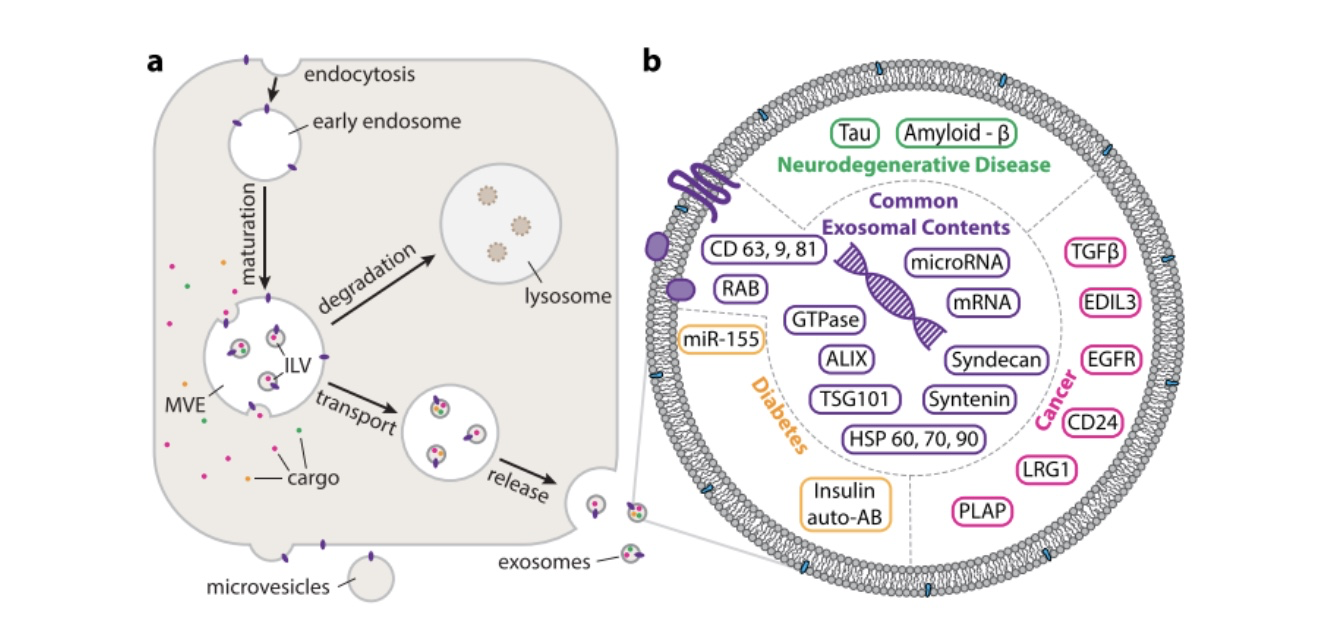
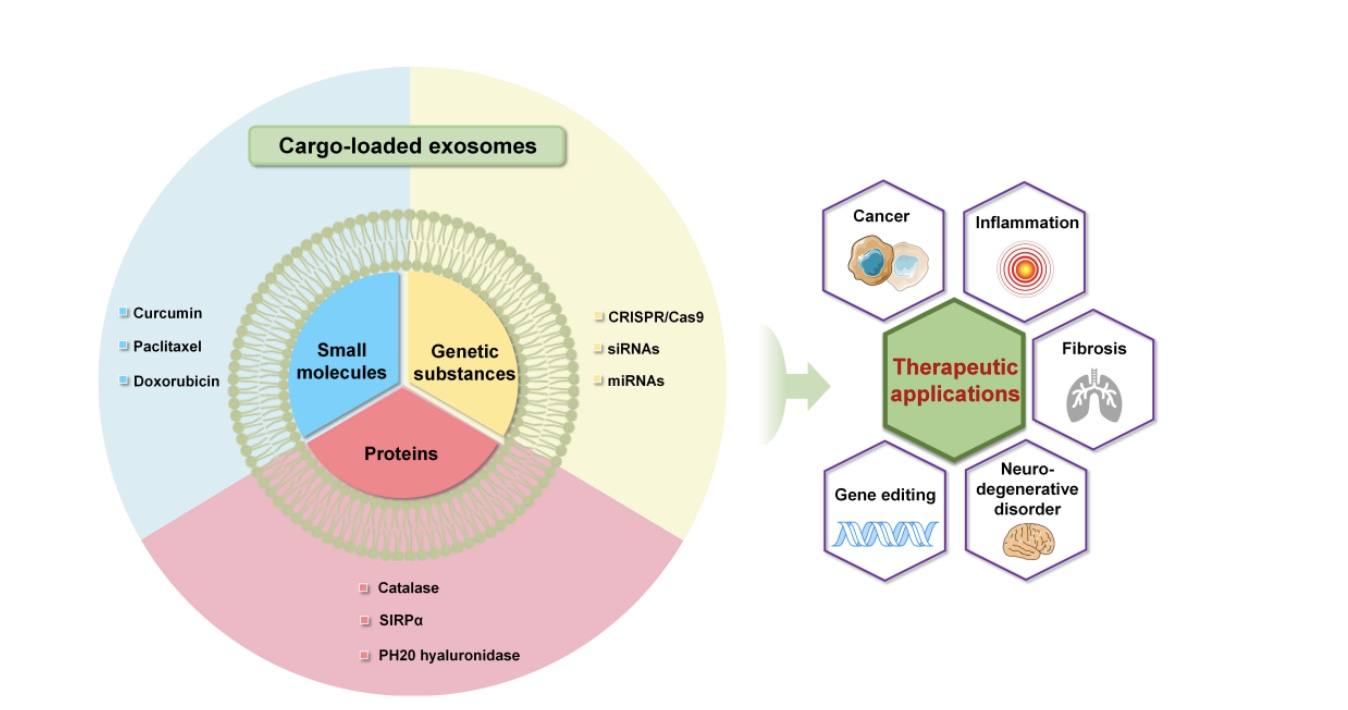
图2:外泌体介导的小分子、蛋白质和遗传物质的递送系统在各种治疗领域应用
三步法纯化外泌体的工艺
外泌体应用于疾病的早期诊断和治疗是通过使外泌体携带相关生物学标记物或携带相关药物来实现。对外泌体进行相应的生物学改造,首先需要分离纯化出纯度较高外泌体。但是因为外泌体尺寸小 (30–150 nm) 、密度低 (1.13–1.19 g/ml) 并且混合与体液中其他相似的成分中(例如细胞碎片、蛋白),使得外泌体的分离具有相当的难度 (Lin et al., 2020) 。进一步研究表明外泌体的生物活性会受到其纯化方法的影响,因此纯化方法的选择对于外泌体的进一步应用会产生重要影响。目前常用的外泌体分离方法主要包括差速离心、尺寸排阻、超滤、聚合物沉淀、免疫亲和及集成微流控法 (Yang et al., 2020) 。
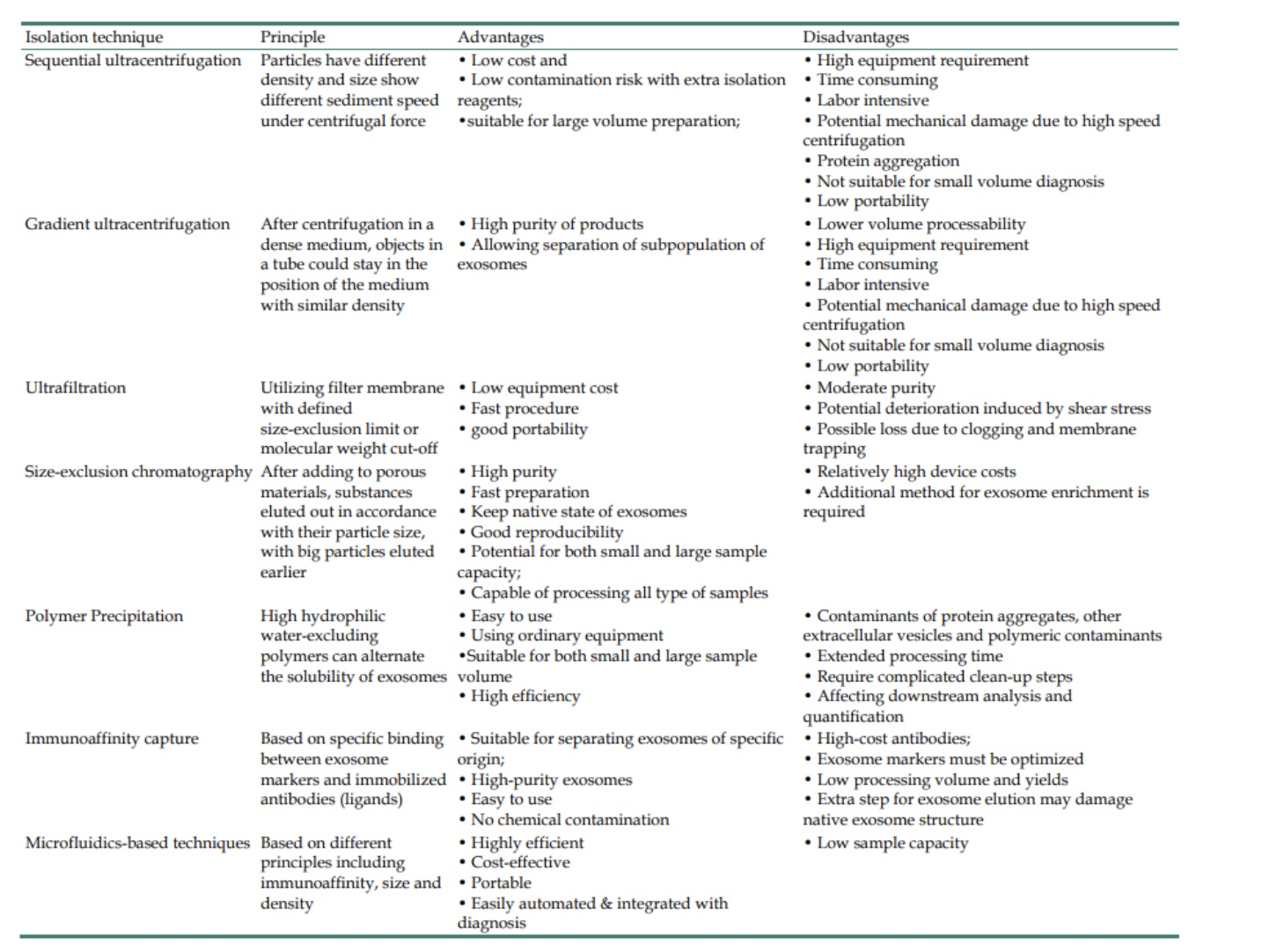
表1:常用外泌体分离方法的优缺点比较
超滤法纯化外泌体
超滤法纯化外泌体是基于尺寸差异的一种分离方法,使用超滤技术不仅可以通过过滤去除小尺寸的杂质获得纯度较高的外泌体,同时具有快速、稳定、操作自动化和高重复利用率的优势,使得这一技术可以在今后的实践中进一步得到应用 (Heinemann et al., 2014) 。超滤依据压力方向的不同分为死端过滤 (Dead-end filtration) 和切向流过滤 (tangential flow filtration, TFF) 两种形式:
死端过滤的压力垂直作用于滤膜,产生的剪切力较大可能造成大囊泡的破裂进而污染外泌体,同时也容易造成滤膜的堵塞 (Batrakova and Kim, 2015) 。
切向流过滤产生的剪切力较小,不易造成滤膜堵塞,样品可以循环多次过滤以提高外泌体纯度。鉴于切向流过滤的这些优势,外泌体的纯化正越来越多的采用切向流的工艺 (Han et al., 2021) 。其中以中空纤维 (hollow fiber) 为基础的切向流过滤已广泛应用于各类外泌体的纯化。

图3:使用切向流的高效外泌体纯化超滤方法
基于切向流过滤的方法进一步发展出适用于大体积生物样品中分离外泌体的方法。这种外泌体分离方法包含了三个独立的模块:
第一步过滤掉直径大于100 nm不具柔性的细胞碎片;
第二步切向流过滤,使用500 kDa MWCO的中空纤维(可以依据具体实验要求选择不同分子量大小)进一步去除小分子如蛋白类物质;
最后通过特定孔径的低压过滤,截留得到纯化的外泌体。这种方法可以简单、快速分离得到特定尺寸的外泌体,半自动超滤设备的使用可以通过检测和维持特定跨膜压,最大限度减小外泌体的结构损伤,保持外泌体功能的完整性。

图4:(A) Cytiva中空纤维超滤设备示意图(通过调节流速维持中空纤维跨膜压的稳定)。(B) 中空纤维液流方向示意图
以上三步法纯化外泌体的工艺中,中空纤维作为其中核心部件,在纯化过程中起到了关键作用。本文以下介绍切向流技术(中空纤维)纯化外泌体应用实例。
切向流技术 (中空纤维) 纯化外泌体应用实例
实例1:间充质干细胞外泌体分离
细胞治疗研究发现间充质干细胞外泌体是最适合临床应用的外泌体类型,但是目前缺少一种分离间充质干细胞外泌体可放大方法。Haraszti等人在比较不同来源间充质干细胞外泌体的产率,发现脐带来源的充质干细胞具有最高的外泌体生产效率。为了获得最高的外泌体回收效率,研究人员使用以微载体为基础的3D细胞培养方式,通过切向流过滤 (TFF) 的方法进行外泌体的分离 (Haraszti et al., 2018) 。切向流过滤 (TFF) 工艺中设置流速120 ml/min,TMP设置3.5 psi。
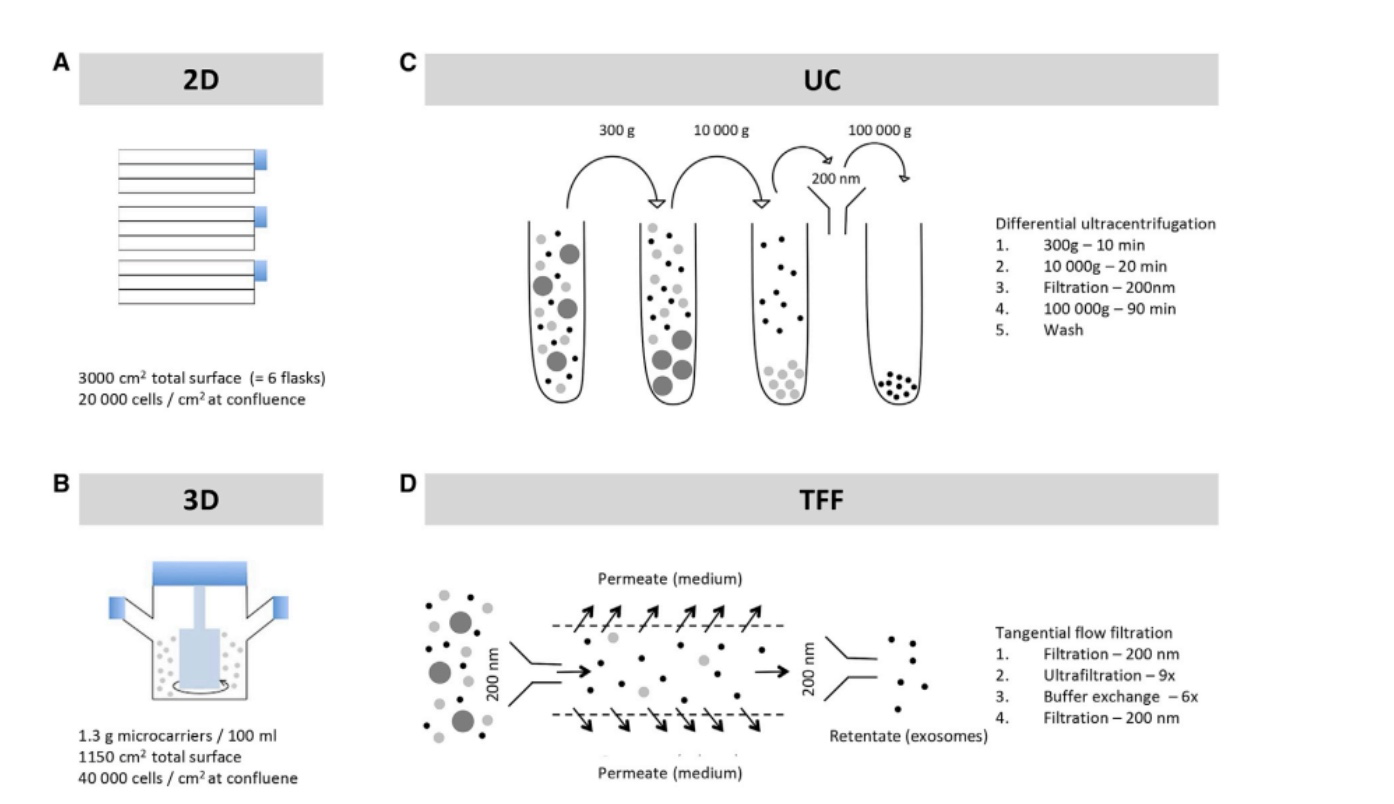
图5:间充质干细胞培养和外泌体纯化模式 (A) 以Flask为基础的2D细胞培养模式 (B) 以微载体为基础的3D细胞培养模式 (C) 超速离心法分离间充质干细胞外泌体 (D) TFF法分离间充质干细胞外泌体
进一步对得到的外泌体分析发现,采用3D细胞培养+TFF分离方式的组合外泌体尺寸分布差异性小,而且外泌体的产率明显的优于其他细胞培养与纯化方法组合方式(图6)。
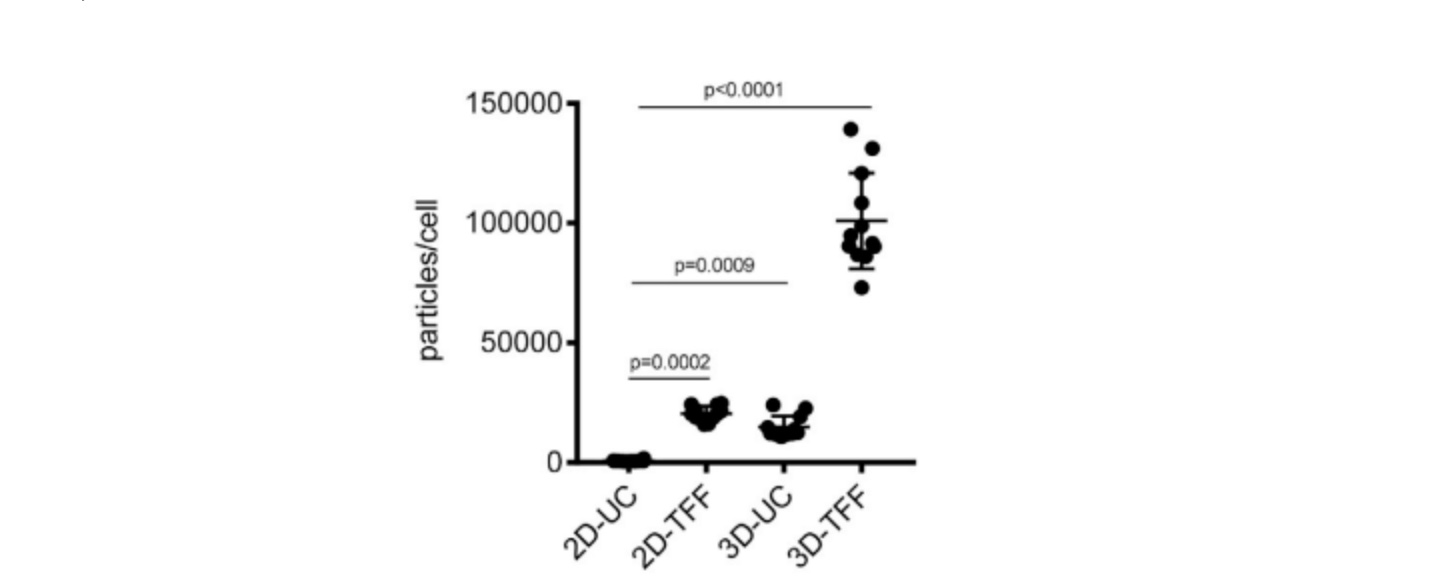
图6:通过2D-UC、2D-TFF、3D-UC或3D-TFF分离的外泌体的产量(每种组合12次测量)
通过对外泌体整合能力的分析,研究人员进一步比较了不同培养方式与分离方法组合所获得外泌体的生物学活力。实验利用外泌体携带siRNA去干扰神经元细胞中Huntingtin基因的表达,并最终以Huntingtin基因的沉默作为外泌体向神经元传递siRNA有效性的量度。研究结果表明使用TFF方式分离出的外泌体具有更高的siRNA传递效率(图7)。

图7:TFF方式分离出的外泌体具有更高的向神经元细胞传递siRNA效率 (A) 用含有指定剂量siRNA的2D-UC,2D-TFF,3D-UC和3D-TFF分离得到的外泌体处理小鼠原代神经元后Huntingtin基因的mRNA表达水平 (B) 用含有Cy3-l的2D-UC,2D-TFF,3D-UC和3DTFF外泌体处理的神经元原发性荧光的变化时间
实例2:心肌源细胞外泌体分离
为了大量制备GMP标准下的心肌源细胞外泌体,在GMP的生产环境中进行心肌源细胞的培养,收集8 L含有外泌体的细胞培养液使用切向流过滤 (TFF) 的方式分离心肌源细胞外泌体。该外泌体分离工艺步骤包括:澄清、浓缩、换液、回收和分装。其中浓缩和换液步骤使用ÄKTA Flux 6封闭设备和300 kDa 截留孔径中空纤维柱 (Andriolo et al., 2018) 。
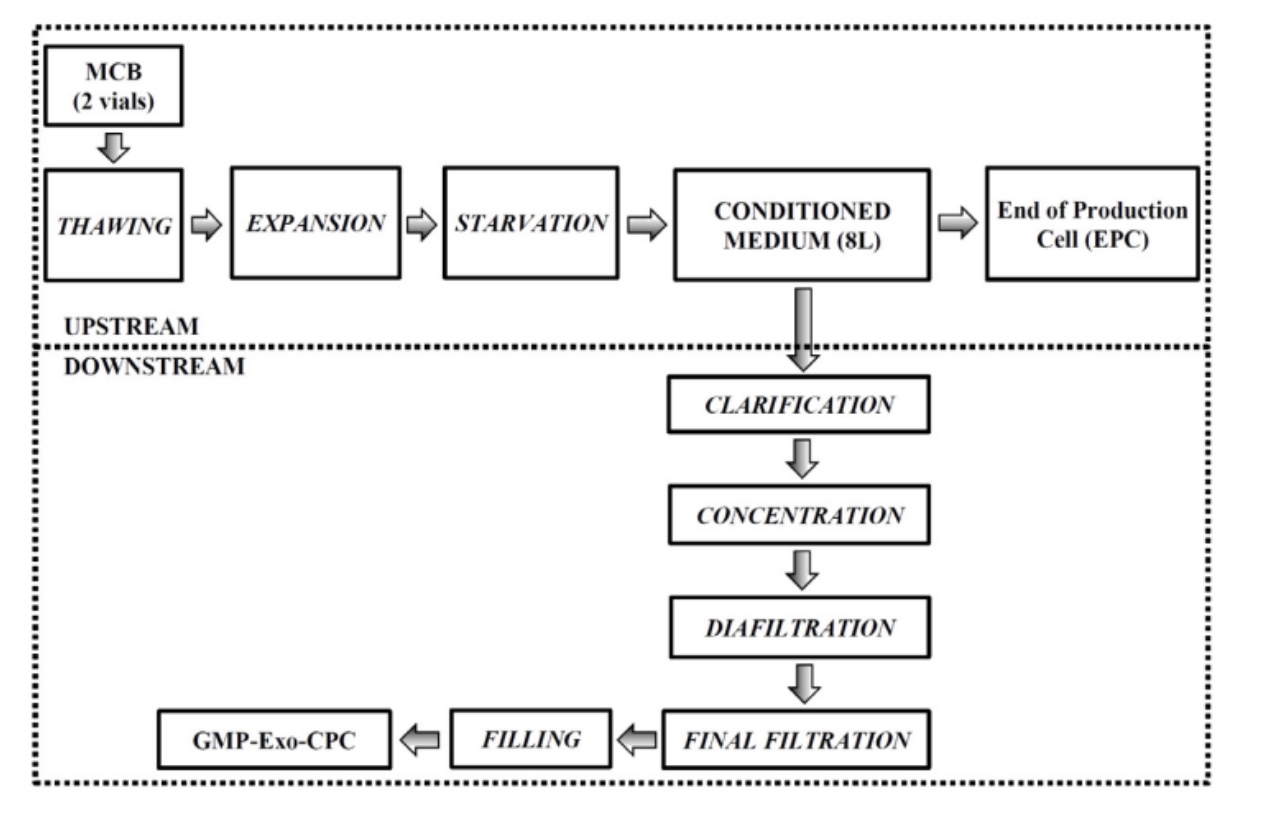
图8:大规模GMP体系生产心肌源细胞外泌体 (Exo-CPC) 上、下游工艺流程
按照上图所示的工艺流程,作者进行2个批次的心肌源细胞外泌体纯化,外泌体的各项质量都达到预设的质量标准(表2)。
表2:GMP生产两个批次外泌体质量结果
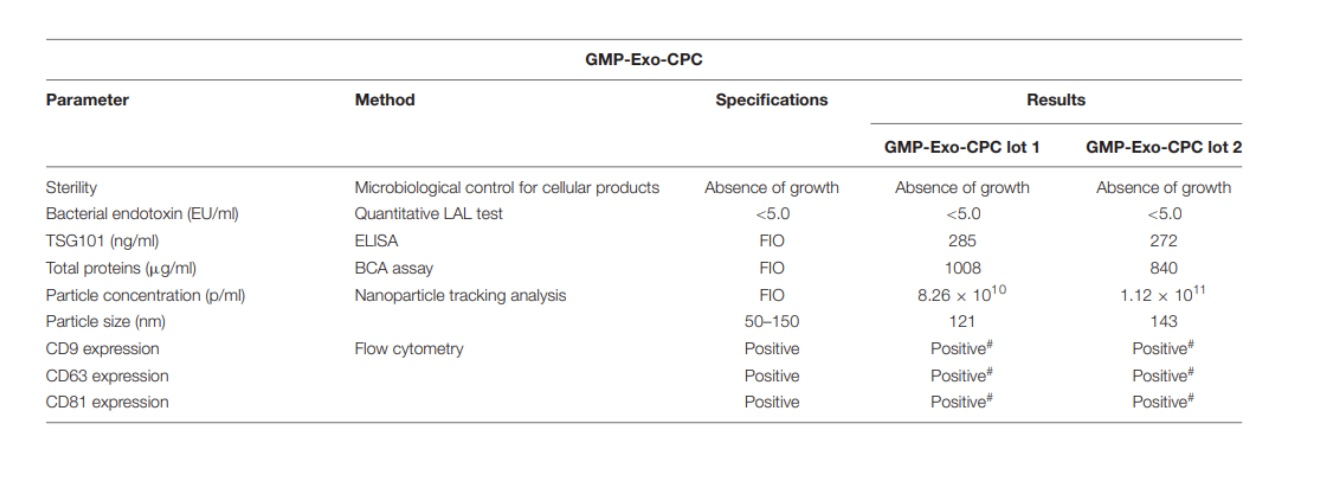
进一步通过流式细胞和电镜分析表明,两个批次分离的外泌体尺寸大小符合预期且包含有CD9、CD63和 CD81等表面标记(图9)。

图9:GMP-Exo-CPC表征。(A) 流式细胞术分析。使用MACSPlex外泌体试剂盒分析了两批GMP-Exo-CPC。数据是为抗原递呈细胞 (APC) 平均荧光强度归一化后,使用抗CD9,抗CD63和抗CD81磁珠获得的平均信号强度。(B) 具有代表性的透射电镜图像。
实例3:乳腺癌细胞外泌体分离
Busatto等人比较了超速离心法和切向流过滤 (TFF) 分离乳腺癌细胞外泌体的结果 (Busatto et al., 2018) 。超速离心法使用100,000× g离心70 分钟。切向流过滤法中首先使用了0.65 µm孔径的中空纤维去除细胞碎片,然后通过截留孔径500 kDa的中空纤维去除其他游离的生物分子(设置流速80 ml/min,剪切力2000 s−1)。两种方法分离外泌体的质量结果见图10。
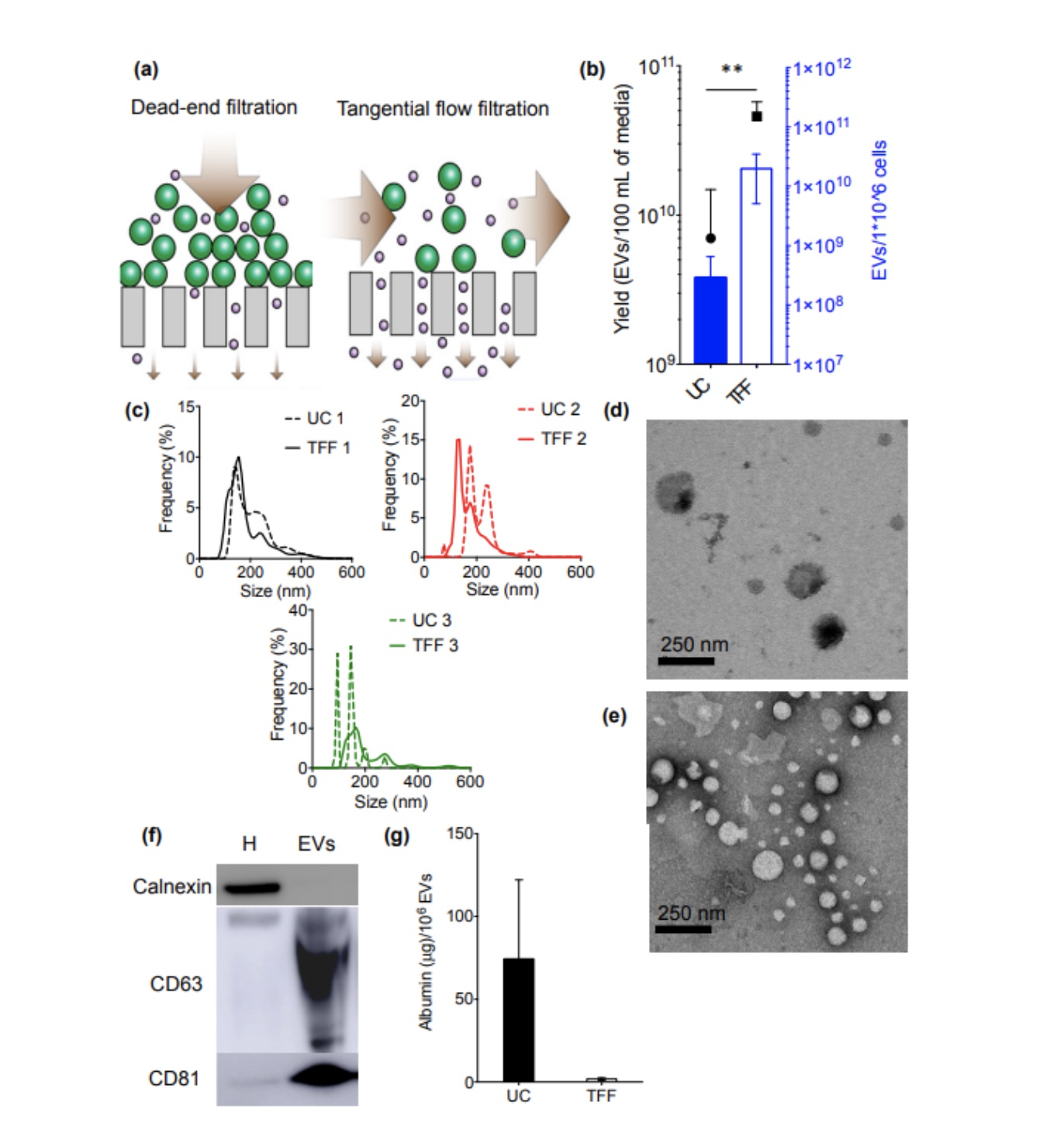
图10:使用超速离心 (UC) 或切向流过滤 (TFF) 分离的MDA-MB-231乳腺癌细胞外泌体生物物理和生化表征。(a) 死端过滤和TFF区别示意图;(b) 外泌体分离收率;(c) UC(虚线)和TFF(连续)分离的EV的尺寸分布 (0-650 nm) ;(d,e) UC (d) 或TFF (e) 获得的外泌体透射电子显微镜(TEM) ;(f) 由TFF分离样品中特征性细胞内(钙连接蛋白)和外泌体 (CD63,CD81) 标志物的蛋白质印迹;(g) 外泌体中白蛋白污染物的水平。数据以三个生物学重复 (b,c) 或实验的平均±标准差表示重复 ,通过t检验评估统计学显著性
实验结果表明在使用相同样品量的情况下 (100 ml) 使用TFF分离外泌体的收获量大约是使用离心方法的5倍。使用TFF分离外泌体的尺寸更加均一 (140–210 nm) ,超速离心方法获得的外泌体尺寸在60–600 nm。WB分析显示TFF分离外泌体CD63和CD81标记的信号水平相比于超速离心方法获得的外泌体分别高出25.2和15.3倍。从白蛋白去除能力的角度TFF方法比超速离心法的去除能力高出了40倍,极大的提高了外泌体纯度。进一步的分析结果表明TFF分离得到的外泌体细菌和微生物检测均为阴性,且内毒素水平低于接受标准。
实例4:神经瘤母细胞 (N2a) 和肌母细胞 (C2C12) 外泌体分离
为了克服超速离心法分离外泌体存在的收率低、外泌体聚集、形态改变和耗时等缺点。Corso等人采用凝胶过滤+TFF的方式纯化神经瘤母细胞 (N2a) 和肌母细胞 (C2C12) 外泌体 (Corso et al., 2017) 。通过低速离心和过滤获得细胞上清,使用中空纤维(截留孔径100 kDa/300 kDa)进行浓缩换液,设置流速100 ml/min,TMP 3.0 psi、剪切力3700 s−1。接着使用Cytiva Capto Core700预装柱对样品进行层析,依据UV280曲线收集对应的组分(图11)。

图11:神经瘤母细胞 (N2a) 和肌母细胞 (C2C12) 细胞外泌体纯化工艺流程
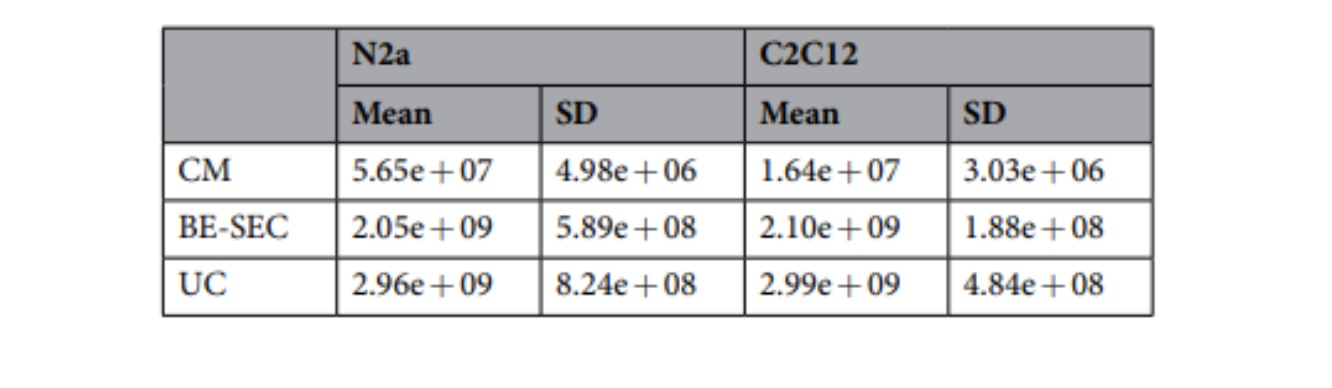
外泌体尺寸分析显示外泌体尺寸符合预期结果 (N2a 107±10nm, C2C12 126±2nm),外泌体收率N2a细胞78.7±17.3% 、C2C12细胞73.8±21.4%。免疫印迹实验验证了外泌体表面存在Alix, Tsg101和CD81生物标志,电镜检测结果显示分离得到的外泌体结构完整。依据Webber 等人提出的外泌体纯度标准particles/µg of protein (P/µg) ,对分离出的外泌体纯度进行评估。评估结果表明使用TFF+凝胶过滤 (BE-SEC) 分离外泌体纯度优于超速离心方法 (UC) 和CM(两步低速离心+ 0.22 μm过滤)分离外泌体的纯度(表3)。
表3:外泌体纯度指数 (Particles/µg of proteins)
总 结
外泌体在细胞治疗领域有着广泛的应用前景,为了满足对外泌体产量、纯度和活性的要求,外泌体的细胞培养和纯化工艺在传统方法的基础上,发展出使用微载体的3D细胞培养工艺和以TFF为主的纯化方法。通过工艺的改进,不仅提高了外泌体的产量,同时外泌体纯度更高、尺寸更加均一、生物学活性更高,这就为外泌体在细胞治疗方面更大规模的使用打下了坚实的基础,进而推动整个细胞治疗领域研究的进展。
参考文献:
Andriolo et al., Exosomes From Human Cardiac Progenitor Cells for Therapeutic Applications: Development of a GMP-Grade Manufacturing Method. METHODS article Front. Physiol., Vascular Physiology Volume 9 – 2018.
Batrakova, E.V., and Kim, M.S. Using exosomes, naturallyequipped nanocarriers, for drug delivery. J Control Release 219, 396– 405 (2015).
Cross flow filtration method. CY14739-24Feb21-HB.
Dongbin Yang et al., “Progress, opportunity, and perspective on exosome isolation – efforts for efficient exosome-based theranostics,” Theranostics 2020, Vol. 10, Issue 8 (2020).
Giulia Corso, Imre Mäger, Yi Lee, André Görgens, Jarred Bultema, Bernd Giebel, Matthew J. A. Wood, Joel Z. Nordin & Samir EL Andalouss. Reproducible and scalable purification of extracellular vesicles using combined bind-elute and size exclusion chromatography. Scientific Reports | 7: 11561 | DOI:10.1038/s41598-017-10646-x (2017).
Han, Z., Peng, C., Yi, J., Zhang, D., Xiang, X., Peng, X., Su, B., Liu, B., Shen, Y., and Qiao, L. Highly efficient exosome purification from human plasma by tangential flow filtration based microfluidic chip. Sens Actuat B-Chem 333, 129563 (2021).
Heinemann, M.L., Ilmer, M., Silva, L.P., Hawke, D.H., Recio, A., Vorontsova, M.A., Alt, E., and Vykoukal, J. Benchtop isolation and characterization of functional exosomes by sequential filtration. J Chromatogr A 1371, 125–135 (2014).
Hollow fiber cartridges and systems for membrane separations. CY16041-24Feb21-HB
Lin, S., Yu, Z., Chen, D., Wang, Z., Miao, J., Li, Q., et al. Progress in Microfluidics-Based Exosome Separation and Detection Technologies for Diagnostic Applications. Small 16, 1903916. doi:10.1002/smll.201903916 (2020).
Reka Agnes Haraszti et al., Exosomes Produced from 3D Cultures of MSCs by Tangential Flow Filtration Show Higher Yield and Improved Activity. Molecular Therapy Vol. 26 No 12 (2018).
Rumiana Tenchov et al., Exosomes-Nature’s Lipid Nanoparticles, a Rising Star in Drug Delivery and Diagnostics. ACS Nano, 16, 17802−17846 (2022).
Sara Busatto, George Vilanilam, Taylor Ticer, Wen-Lang Lin, Dennis W. Dickson, Shane Shapiro, Paolo Bergese and Joy Wolfram. Tangential Flow Filtration for Highly Efficient Concentration of Extracellular Vesicles from Large Volumes of Fluid. Cells, 7, 273; doi:10.3390/cells7120273 (2018).
Xia Li et al., “Challenges and opportunities in exosome research—Perspectives from biology, engineering, and cancer therapy,” APL Bioeng. 3, 011503 (2019).

