有一类慢性疾病,有着「不死癌症」的恶誉。其以经常性的腹泻、恶心、腹胀为特征,整个肠壁广泛发炎、溃烂,严重者无法进食。这就是炎症性肠病(IBD)。预估在 2025 年,中国的炎症性肠病患者人数将达到 150 万人。
面对这种疾病,我们知之甚少,尚无有效的根治手段。因而,建立有效的疾病研究及药物筛选模型至关重要。
IBD 的发病机制,肠上皮成
关键「边界线」
炎症性肠病以克罗恩病(CD)和溃疡性结肠炎(UC)为代表,是一种病因不明的胃肠道慢性复发性炎症疾病,其发病与遗传易感、免疫失调、肠上皮机械屏障受损、肠道微生态失调和环境影响等因素有关。
其中肠上皮细胞(IEC)是体内和体外的边界,直接面对微生物群和环境影响。另一方面,肠上皮细胞通过直接接触或通过各种细胞因子与下层免疫细胞双向相互作用。除此之外,遗传因素还可能影响肠上皮细胞的功能。由此看来,肠上皮细胞构成了这些元素与宿主之间的界面,其在维持肠道内环境稳定方面起着关键作用 [1]。
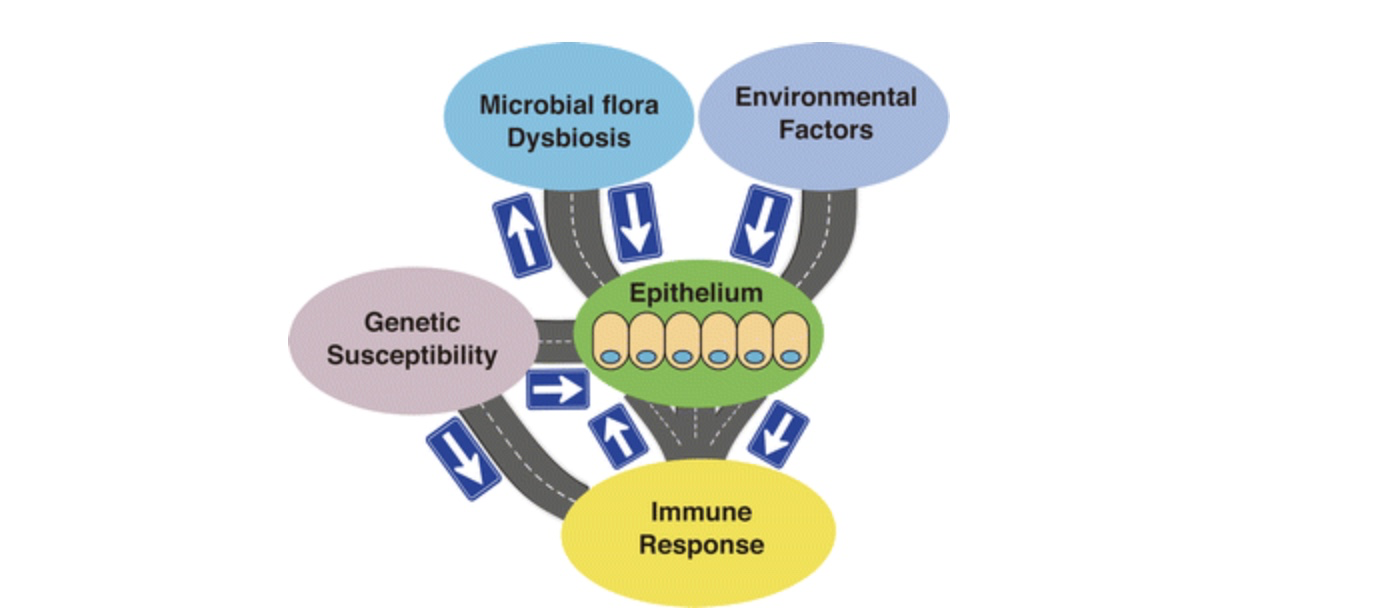
图1 肠上皮是 IBD 发病影响因素的交界面
IBD 研究「网红」模型,肠道
类器官的诞生
尽管早在 2016 年,科学家便已经意识到肠上皮的功能破坏与 IBD 的发病机制密切相关,然而,至今尚未开发出直接针对 IBD 患者 IEC 变化的药物。这可能归因于原代 IEC 无法进行长期培养,之前的药物开发多数基于永生细胞系或动物模型,但是这些模型在发病机制上与人类 IBD 仍存在较大差异。
2009 年,一项重大技术——肠道类器官 3D 培养体系的诞生,为 IBD 肠上皮层的研究提供了可行、可信的体外模型。肠上皮层由隐窝和绒毛结构组成,Sato 等人从小鼠小肠分离得到隐窝,并在含有 ENR(EGF、Noggin、R-spondin)的基质胶培养体系中培养,建立了小鼠小肠类器官 3D 培养系统 [2]。
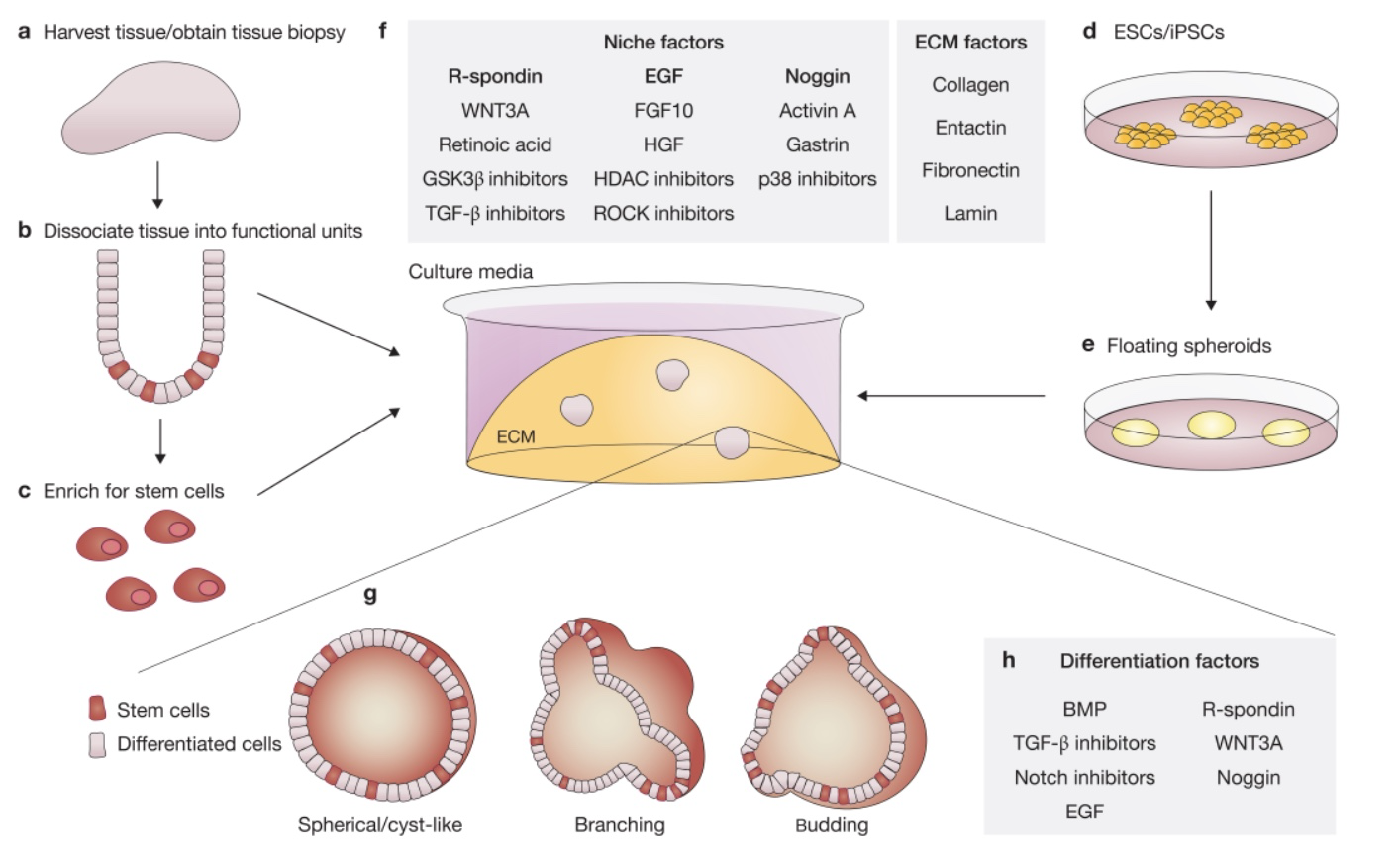
图 2 肠道类器官 3D 培养系统示意图
一
肠类器官为何成新晋「顶流」?
肠类器官培养系统可以克服永生上皮细胞系、人类胎儿肠道器官培养物和动物模型的局限性:
1
永生细胞系通常表现出与原代细胞显著不同的基因型和表型,而肠类器官培养是一种原代培养系统,即使在多次传代后仍能保持人肠上皮的体内特性。
2
目前正常生长的人类癌源性肠上皮细胞系由单一细胞类型(例如Caco-2,HT29)组成,因此无法再现正常肠上皮细胞类型的多样性。相比之下,肠类器官可以在隐窝或绒毛结构中产生所有类型的上皮细胞(例如:肠干细胞 ISCs、Paneth 细胞、肠内分泌细胞、杯状细胞、簇细胞和微折叠细胞等)[2],其中每种类型的肠上皮细胞通过旁分泌和自分泌机制与其他类型的肠内皮细胞相互作用。
因此,肠类器官可以更真实地反映肠上皮层的正常生理或疾病发病机制。
二
应用实例:肠类器官助力IBD新治疗靶点的发掘
溃疡性结肠炎(UC)应用:有研究以正常人肠类器官和 IBD 患者肠类器官为模型进行对比,从而从基因差异角度发现新的治疗靶点。Isabella Dotti 等人比较了来自对照组和 IBD 患者(UC)的肠类器官的基因表达和 DNA 甲基化情况。研究结果发现,与对照组肠类器官相比,UC 患者的肠类器官中有一组基因表达异常,包括与抗菌防御(LYZ,PLA2 G2A)和黏液分泌功能(ZG16,CLCA1)相关的基因 [3]。这些与上皮屏障功能障碍相关的基因可能是未来 IBD 治疗的潜在药物靶点。

图 3 对照组和 UC 患者的肠类器官中的差异基因表达谱
克罗恩病(CD)应用:在 CD 和肥胖患者中观察到内脏脂肪堆积与慢性肠道炎症有关,这表明肠道脂肪细胞的积累可以触发局部炎症信号传导。Yu Takahashi 等人通过构建肠类器官,进行了肠上皮细胞(IEC)和脂肪细胞之间直接相互作用的研究。实验发现,当 IEC 与脂肪细胞共培养时,可以观察到相互激活的炎症反应 [4],这表明脂肪细胞可能是 CD 治疗的一个有前景的药物靶点。
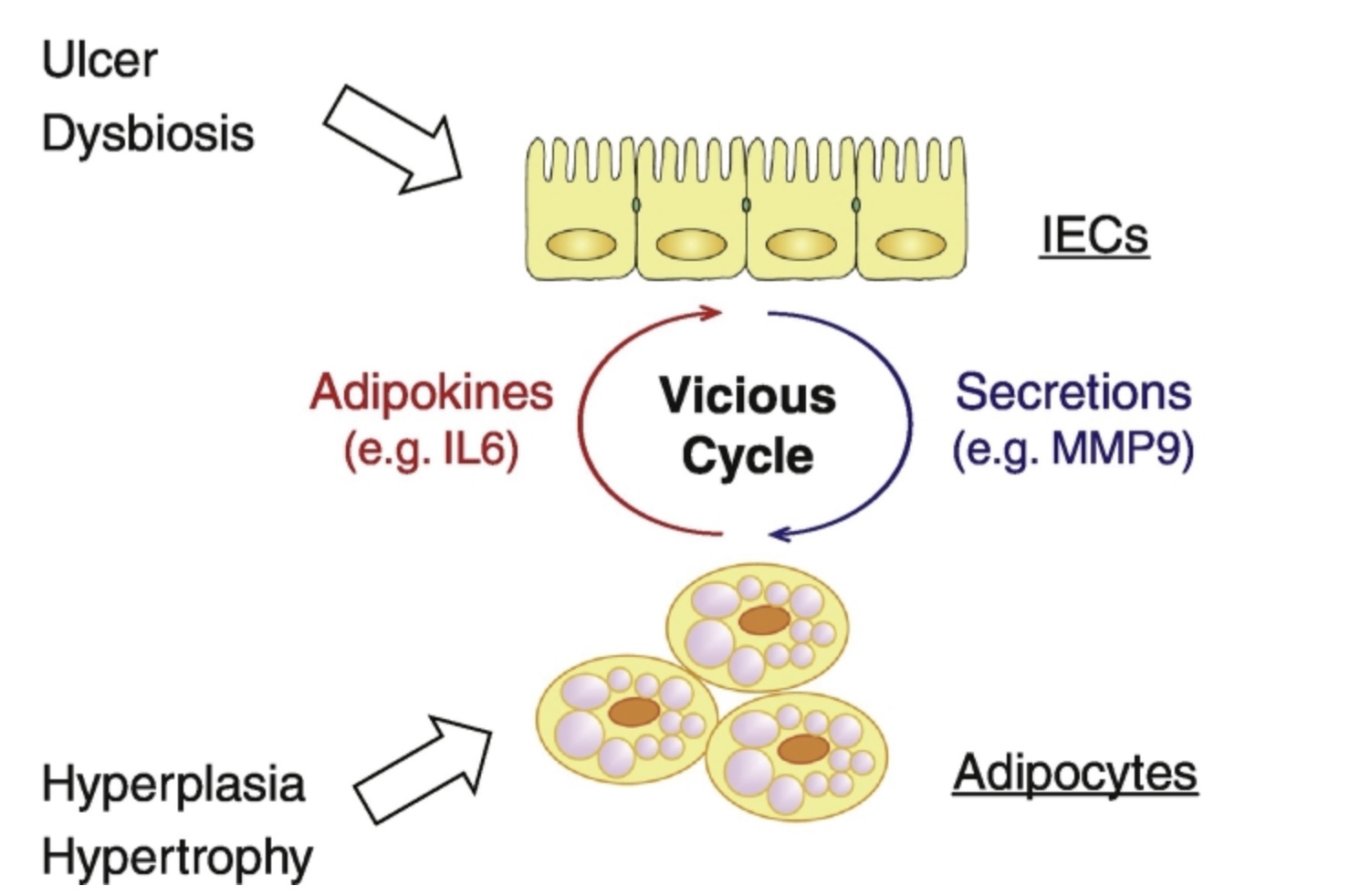
图4 IEC和脂肪细胞之间诱发恶性炎症循环的旁分泌
回路示意图(推测)
三
肠类器官未来可期,但挑战仍在
尽管相较于传统的 IEC 模型,肠类器官培养系统具有很多优势,但其距离成为成熟的 IBD 研究工具仍有问题亟待解决。首先是来自样本的挑战,在 IBD 患者的粘膜中,由于固有层内的高度炎症和促凋亡环境,出现过度的细胞死亡现象。因此,分离的肠隐窝和肠干细胞的数量少且质量差,从而导致低的类器官成功率;其次是类器官培养条件的限制,肠类器官培养系统缺乏生理管腔和血流以及蠕动引起的重复收缩,这会导致基因表达和细胞功能/形态的改变,但微流控技术的兴起似乎为这一问题带来新的解决方案。
为获得更高的类器官成功率,Bio-Techne 可提供针对肠道类器官培养的全套产品解决方案,包括细胞因子:如 WNER(分别代表:Wnt-3a、Noggin、EGF 和 R-Spondin 1);小分子化合物:Y-27632、SB 202190、A83-01;培养基添加剂:N2MAX Media Supplement;BME(BME001-05,3533-010-02)等工具,以保持一致、可重现的培养条件,促进类器官的稳健生长。
参考文献
1. Okamoto, R., Watanabe, M. Role of epithelial cells in the pathogenesis and treatment of inflammatory bowel disease. J Gastroenterol 51, 11–21 (2016).
2. Sato, T. et al. (2009) Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature 459,262–265.
3. Dotti I, Mora-Buch R, Ferrer-Picón E, et al. Alterations in the epithelial stem cell compartment could contribute to permanent changes in the mucosa of patients with ulcerative colitis. Gut. 2017;66(12):2069-2079.
4. Takahashi Y, Sato S, Kurashima Y, Lai CY, Otsu M, Hayashi M, Yamaguchi T, Kiyono H. Reciprocal Inflammatory Signaling Between Intestinal Epithelial Cells and Adipocytes in the Absence of Immune Cells. EBioMedicine. 2017 Sep;23:34-45.

