研究背景
微生物和宿主相互作用在结直肠癌(colorectal cancer,CRC)的进展中起着至关重要的作用,许多前期的实验证明细菌的病原体可以通过多种方式调节宿主的表观基因组学,其中RNA m6A甲基化是至关重要的一种。m6A修饰及其相关蛋白的失调已显示出对人类癌变的显著影响,但微生物-宿主互作用是否影响宿主mRNA的m6A修饰及其潜在机制仍不明确。
主要实验方法及结果
01
形核梭杆菌在人CRC细胞和PDX组织中可以减少METTL3介导的m6A修饰
作者使用HCT116细胞建立了CRC细胞模型并从CRC病人中获取了人源肿瘤异体移植模型(PDX)模型,并进行核梭杆菌处理。
(1)通过Dot blot、和UHPLC Q-Exactive质谱分析观察到CRC细胞与形核梭杆菌共培养后,CRC细胞里的m6A和mRNA m6A的修饰水平都显著地降低了(图10/a,b,c);
(2)通过WB实验可以发现,经过形核梭杆菌处理过的CRC细胞显著降低了METTL3的表达水平,但是并没有观察到对于其他m6A erasers或readers的影响(图10/e);
(3)在PDX模型里也观察到了一致的结论:METTL3 mRNA在经受形核梭杆菌处理过的PDX中水平显著降低(图10/g,h)。
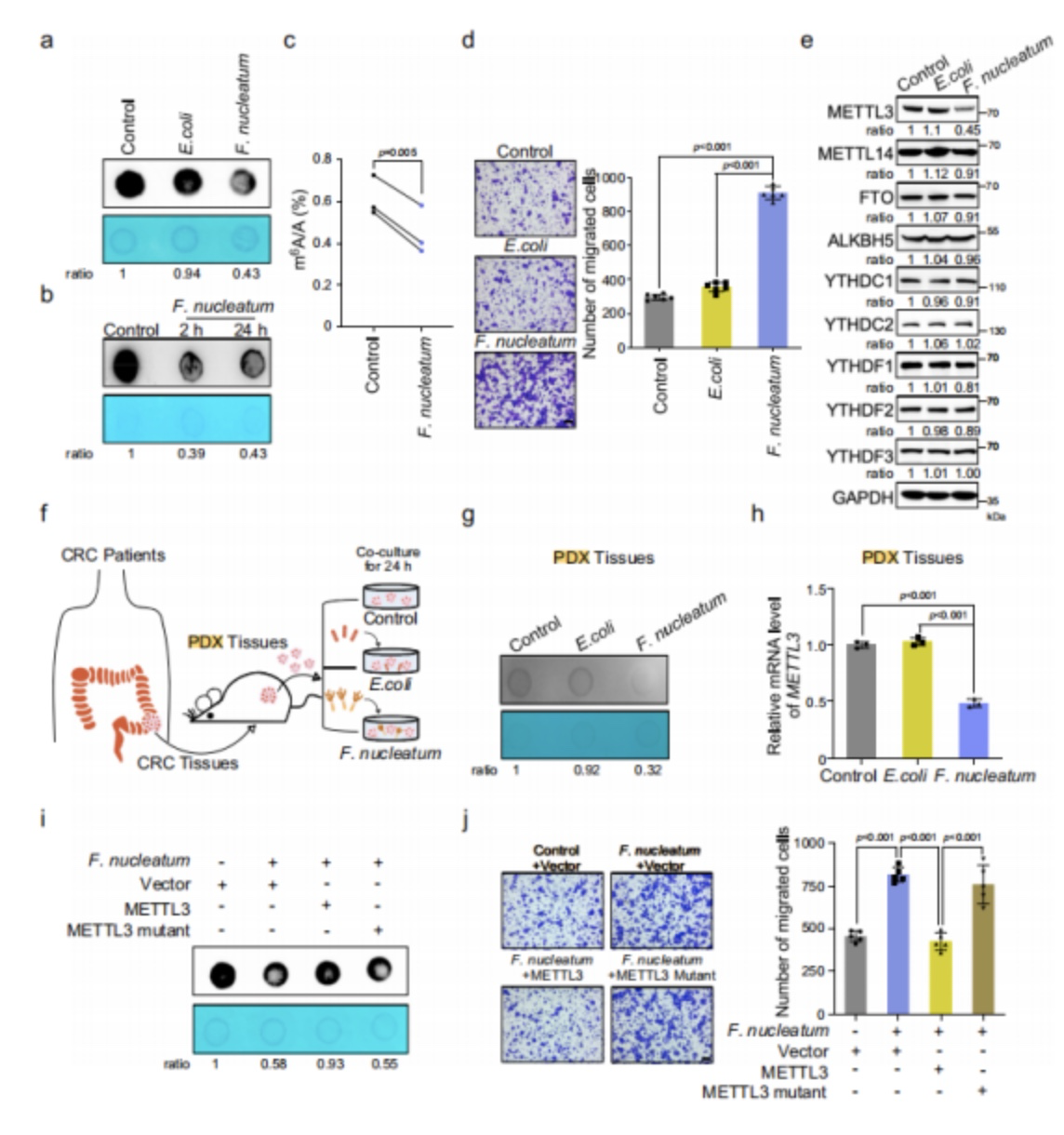
图10. 形核梭杆菌在人CRC细胞和PDX组织中减少METTL3介导的m6A修饰
02
形核梭杆菌通过调节Hippo-YAP信号通路来抑制METTL3
为了探索形核梭杆菌如何抑制METTL3并进一步调节m6A修饰的稳态的机制,作者筛选了经形核梭杆菌处理后的CRC细胞中受到激活的信号通路。
(1)通过qRT-PCR可以筛选出CRC细胞中经形核梭杆菌处理后被激活的信号通路,实验结果显示与NF-κB和Hippo-YAP两个信号通路相关的基因在CRC细胞中均被激活了(图11/a,b);
(2)通过免疫荧光实验和荧光素酶的实验结果也进一步证实了经形核梭杆菌处理的CRC细胞中YAP的水平也显著的升高(图11/d,e);
(3)作者又通过WB实验证实了在经形核梭杆菌处理后的CRC细胞中,MST1/2 和 LATS1/2的磷酸化水平显著的降低(图11/f);
(4)通过Transwell实验想要进一步证实YAP信号通路是否可以通过调节形核梭杆菌的功能来促进CRC的聚集,实验结果显示YAP的敲除可以显著降低CRC细胞迁移的能力(图11/g)
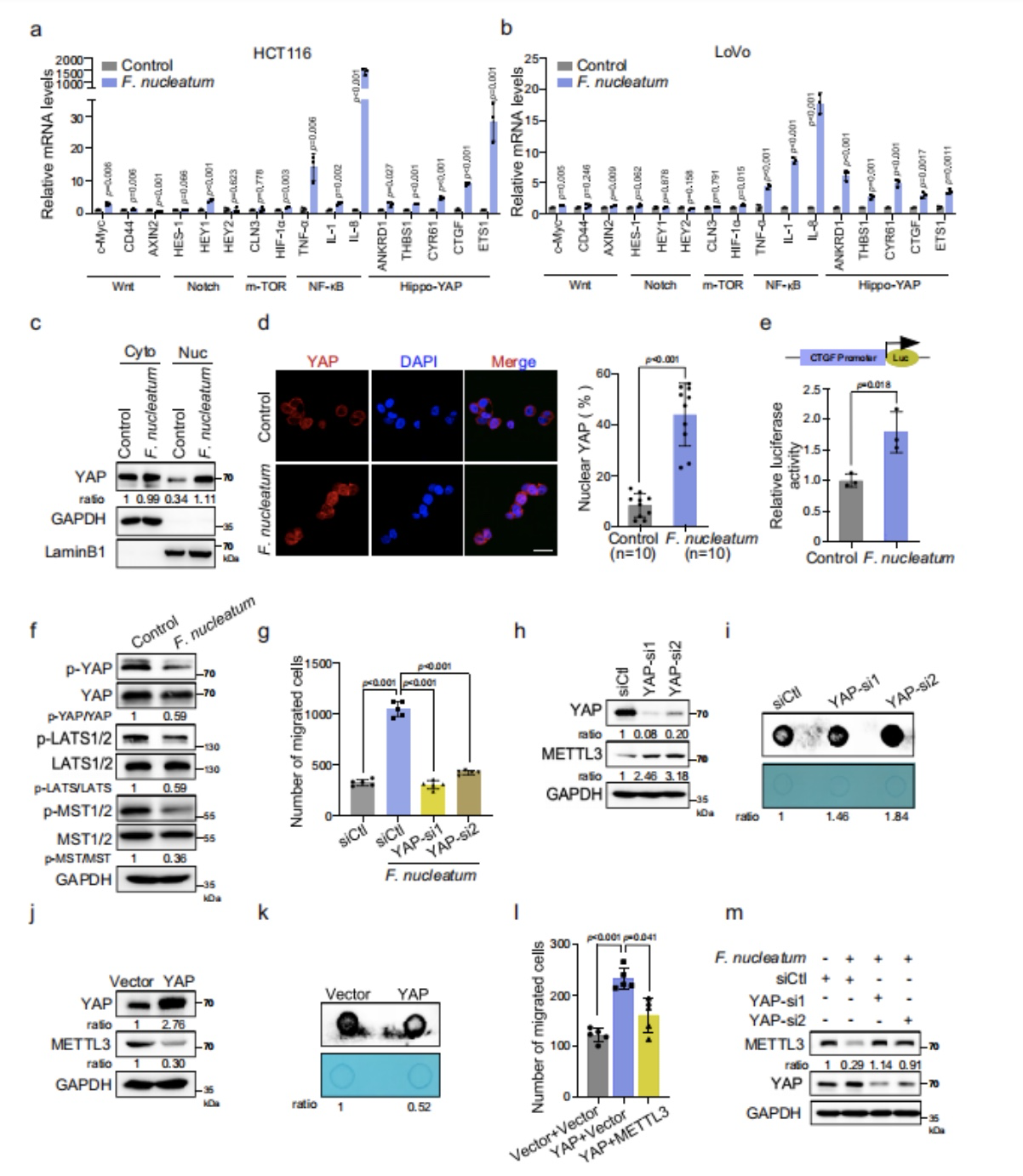
图11. 形核梭杆菌通过调节Hippo - YAP信号通路来抑制METTL3
03
FOXD3是METTL3的转录因子之一
接着作者想要探究YAP信号通路是通过什么机制来调节METTL3的表达,作者一开始想到的是通过TEAD转录因子(因为有研究证明YAP通过与TEAD转录因子的关联来调节基因转录),但是作者在METTL3启动子中未找到TEADs的结合位点。因此作者通过线上生物信息平台来预测了可能的转录因子,找到了FOXD3(图12/a)。
(1)通过WB实验观察到FOXD3的异位表达显著增加了METTL3的mRNA(结果中没有展示)和蛋白水平(图12/b);相反地,FOXD3敲除后的,METTL3的mRNA(结果中没有展示)和蛋白水平(图12/c)得到了显著降低;
(2)接着为了进一步证实FOXD3是METTL3的直接转录因子,作者进行了ChIP实验,结果表明了FOXD3与METTL3的启动子结合;在FOXD3-P1和FOXD3-P2这两个区域都可能包含假定的FOXD3结合元素(图12/f);
(3)双荧光素酶实验结果也证明了FOXD3的过度表达可以显著提高CRC细胞中METTL-荧光素的活性(图12/f)
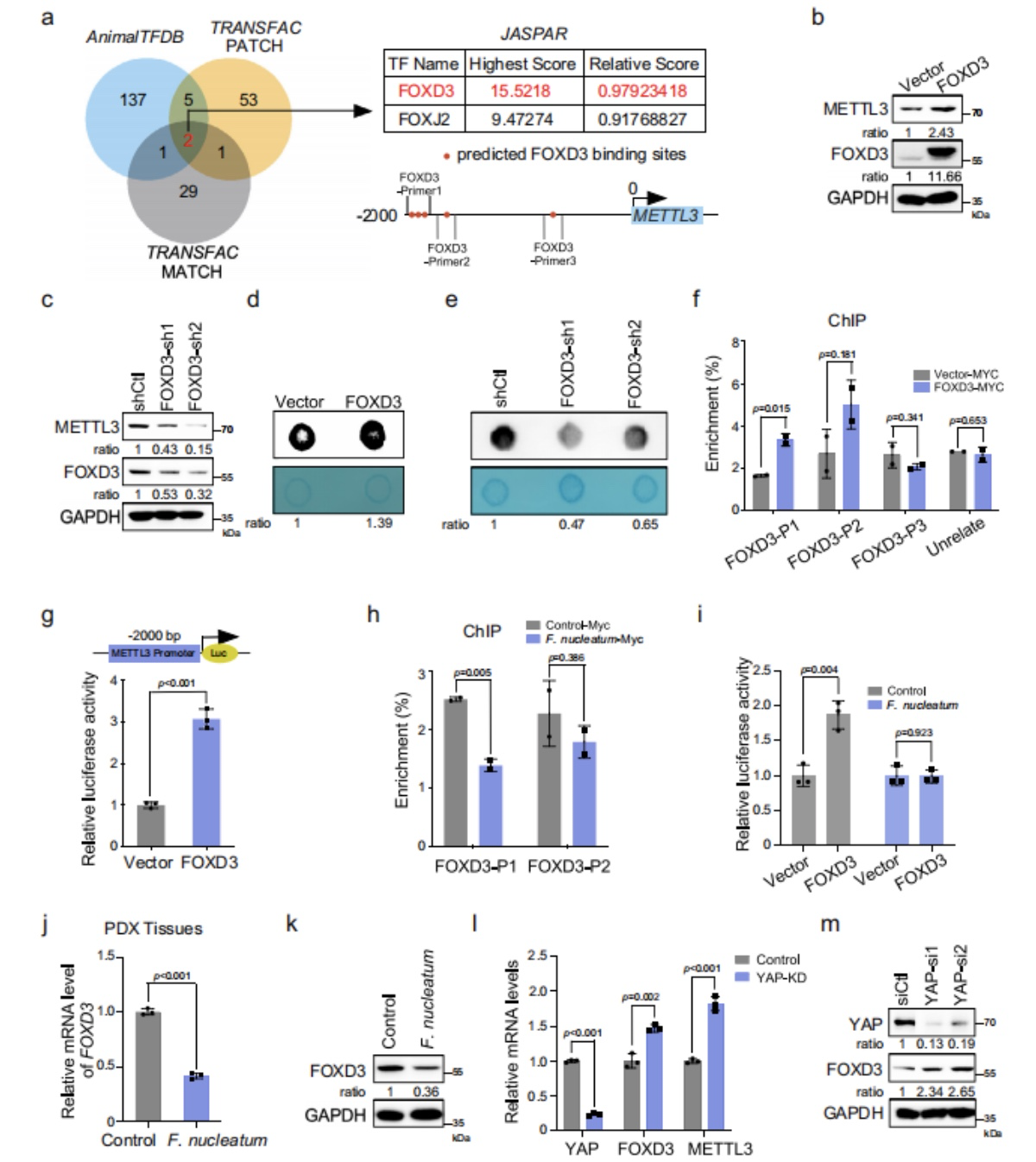
图12. FOXD3是METTL3的转录因子
04
通过m6A-seq和RNA-seq测序发现KIF26B是METTL3下游调控基因
为了研究m6A修饰在特定基因中的变化,作者在形核梭杆菌处理过的CRC细胞中进行了m6A-seq测序。发现有5841个m6A峰值在这些CRC细胞中发生了变化,其中有2835个上调的峰值,3006个下调的峰值。作者观察到在经形核梭杆菌处理后的细胞中,m6A在5'UTR附近出现峰值,而mRNA的CDS区域减少,尽管3'UTR区域保持相似的丰度。
KEFF结果显示了形核梭杆菌可通过多方面影响CRC细胞,如粘着性和Hippo信号通路(图13/d);GO结果则显示了这些细胞中,m6A修饰发生在少数与调节GTPase活性、细胞骨架组织和细胞极性重塑相关的基因上(图13/e)
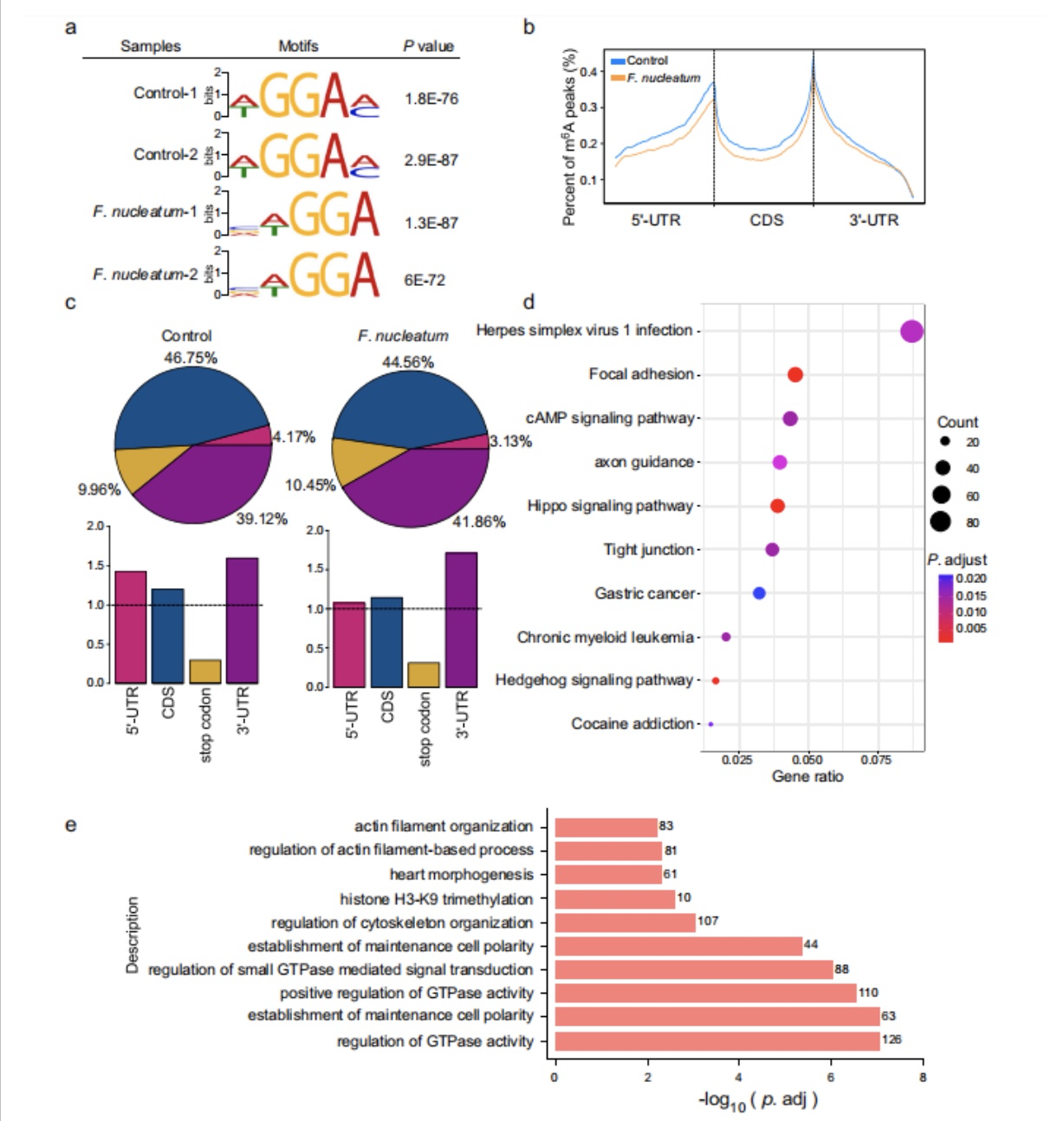
图13. 经形核梭杆菌处理后的CRC细胞中,m6A调控基因的变化
通过对比经形核梭杆菌处理的CRC细胞和对照组的热力图,发现155个上调的基因和88个下调基因,其中有5个基因是在m6A测序和mRNA测序中相重合后的结果(图14/a,b),在这5个基因中,作者初步是被出了KIF26B,因为其参与了细胞骨架识别(这个生物活动对于CRC的聚集十分重要)。
为了进一步证实KIF26B mRNA是METTL3的靶标,作者进行了RNA免疫沉淀实验(RIP),其中METTL3靶基因CREBBP做为阳性对照,而HPRT1做为阴性对照。结果显示KIF26B的表达受YAP/FOXD3/METTL3轴的调控,且KIF26B受核梭杆菌影响的上调也取决于METTL3的m6A甲基转移酶活动(图14/h,i,j)。
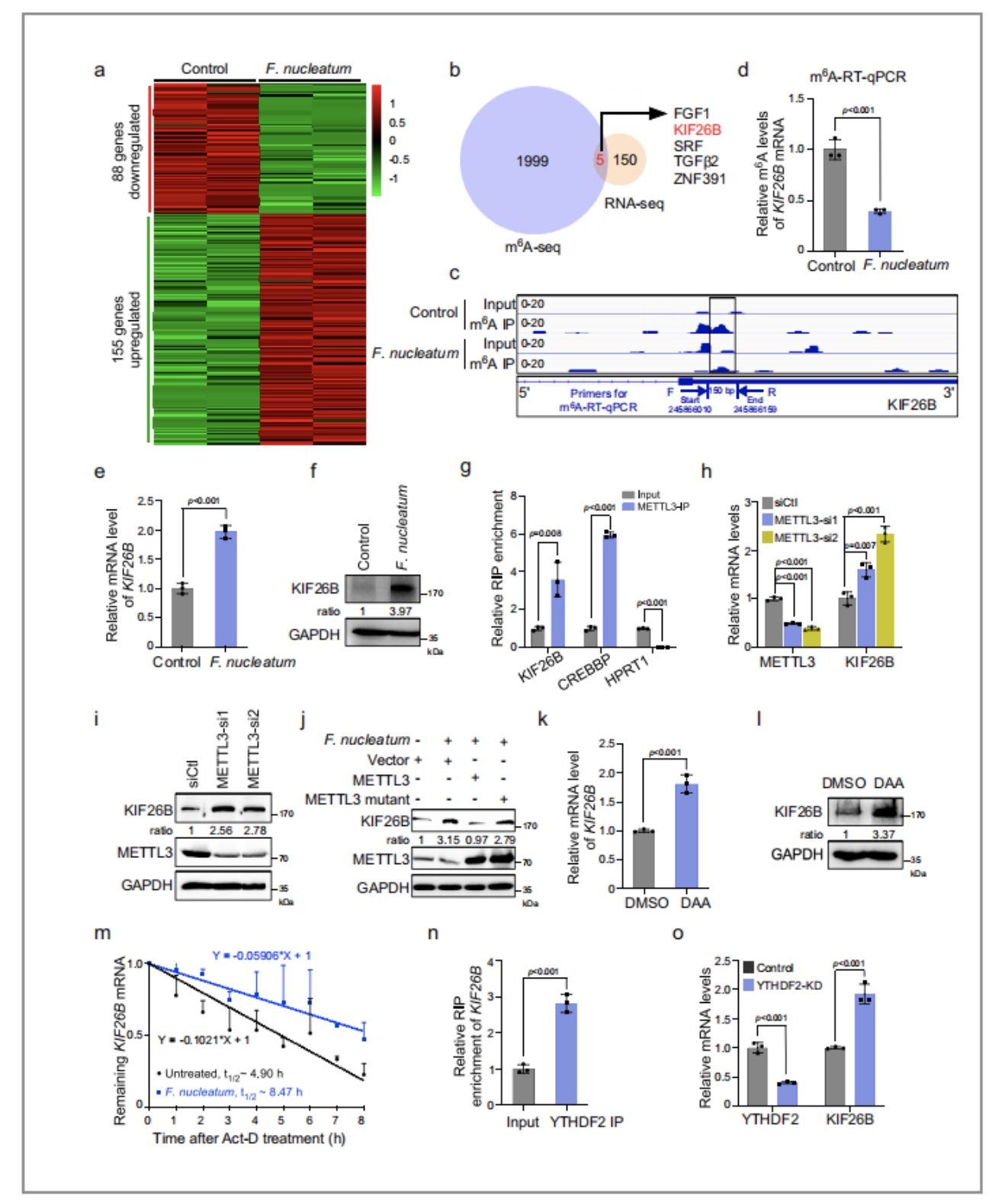
图14. 通过m6A-seq和RNA-seq测序发现,KIF26B是METTL3的下游靶点
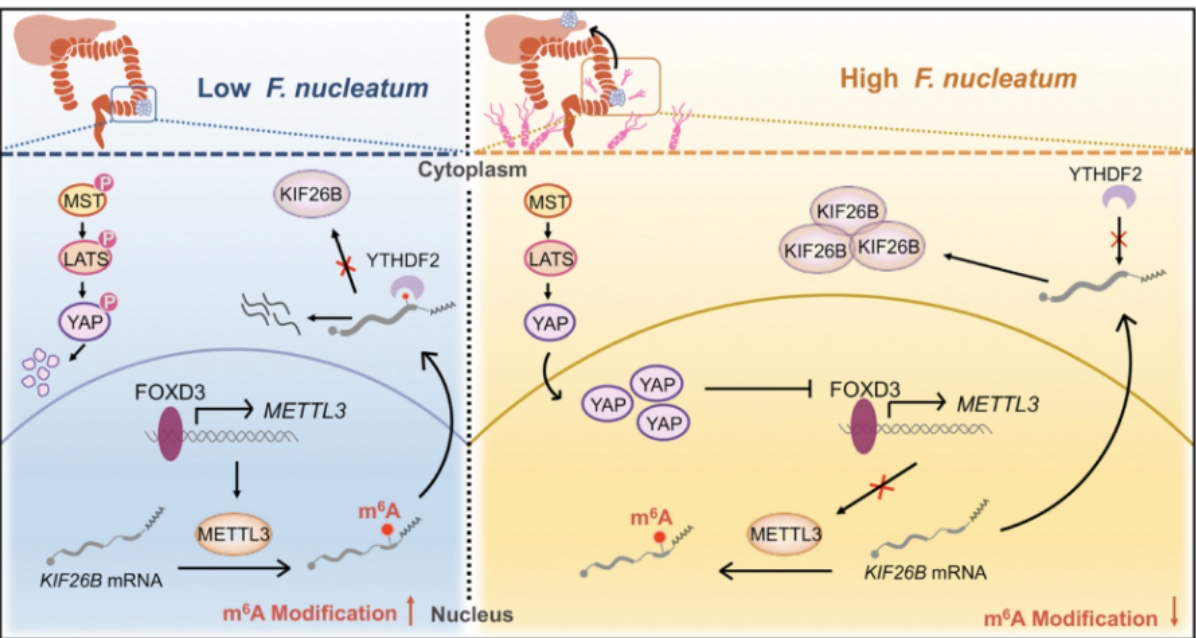
以上实验结果均表明了形核梭杆菌诱导的METTL3下调降低了KIF26B的m6A修饰水平,并进一步降低了YTHDF2依赖的mRNA降解,从而促进了KIF26B在CRC细胞中的表达,因此证明了KIF26B是METTL3下游调控基因。
05
形核梭杆菌通过上调KIF26B来加速CRC的聚集和转移
据证实,KIF26B作为癌基因会参与胃癌和乳腺癌,但其在CRC中可能的调控机制还未被明晰,因此作者在CRC细胞中对KIF26B进行了敲除并进行了mRNA的测序(图15/a),初步证实了KIF26B与CRC的聚集有关联(图15/b)。
(1)通过m6A RIP-seq检测发现,在KIF26B基因的调控下,Hippo信号通路被显著地激活了(图15/c)
(2)同时,作者在经METTL3敲除后的CRC细胞中进行了KIF26B基因的沉默,接着通过WB实验发现(图15/d,f),由METTL3敲除而引起的KIF26B基因的缺失会减弱CRC细胞的迁移
(3)通过RIP-qPCR实验发现(图15/n)
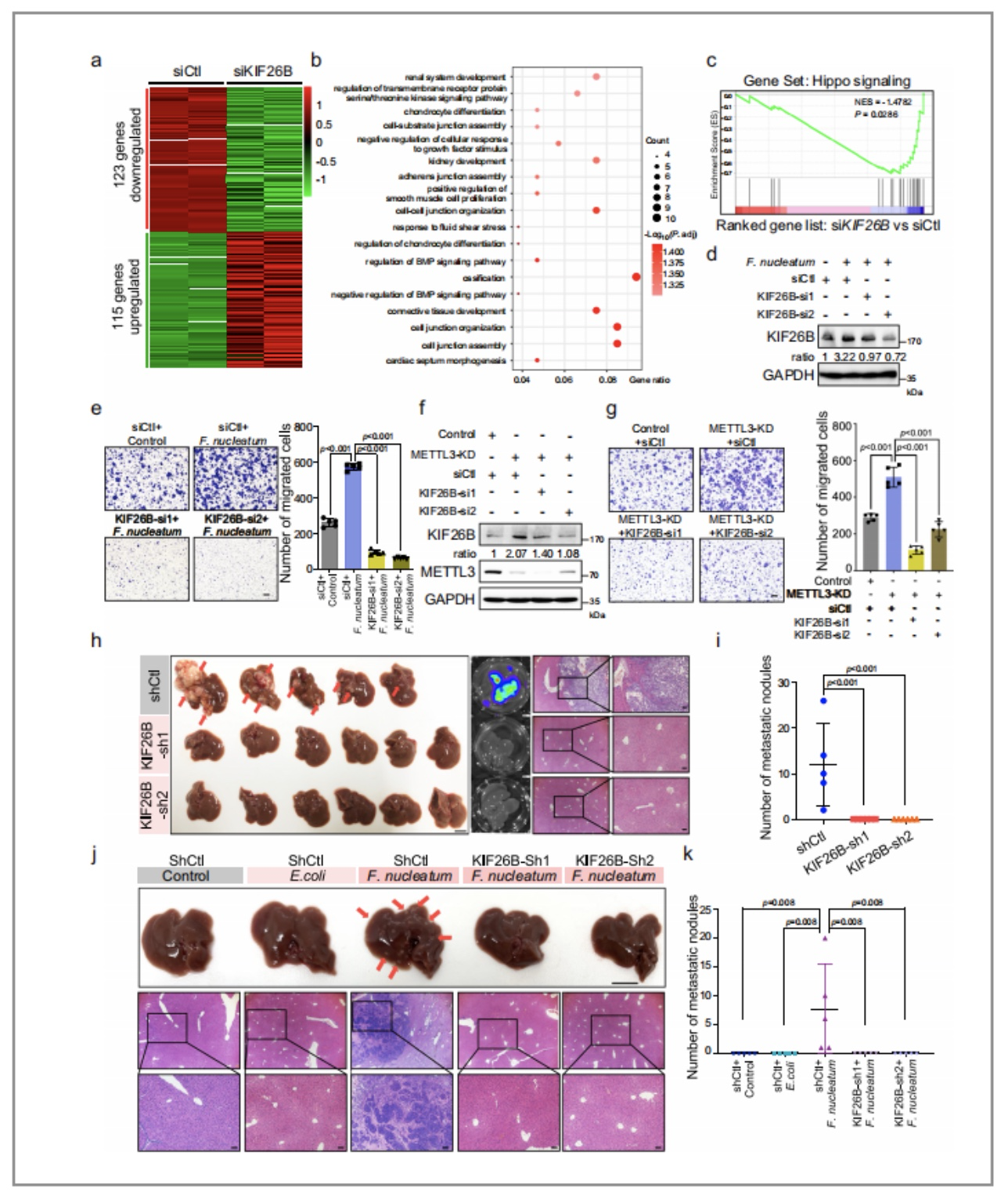
图15. 核梭杆菌通过上调KIF26B加速CRC的侵袭性和转移性
结论
经证实,核梭杆菌与CRC患者METTL3和KIF26B表达相关,具体的调节机制如图16所示: