研究背景
胰腺癌(pancreatic cancer,PC)是一种发病隐匿、诊断困难、手术切除率低的高度恶性胃肠肿瘤,已成为世界范围内最常见的致死性疾病之一,其5年生存率仅为8%。因此,迫切需要阐明PC背后的分子和细胞机制,以达到诊断和治疗干预的目的。m6A是真核生物mRNA中含量最多的可逆甲基化修饰,早被证实其参与肿瘤的发生发展,但关于其对于胰腺癌的作用机制尚不明确。作者在这篇文章中重点探讨了m6A去甲基化酶ALKBH5在胰腺癌中的作用。
实验方法
实验方法主要包括以下5个部分:
❖
从PC病人中收集了42个PC样本,并使用real-time PCR、WB和IHC实验对其ALKBH5的表达及临床病理影响进行评估;
❖
在获得功能和失去功能分析的基础上,使用RNA测序研究ALKBH5对PC细胞生物学特性的影响;
❖
使用流式细胞术、WB等对小鼠样本的皮下和原位模型进一步研究,用于揭示ALKBH5在肿瘤生长中的作用;
❖
通过MeRIP-qPCR(RNA甲基化测序-qPCR)对mRNA和m6A进行测序用于确定ALKBH5对PER1的靶向作用;
❖
通过ChIP和荧光素酶检测ALKBH5启动子中的p53结合位点,揭示ALKBH5与PER1激活的ATM-CHK2-P53/CDC25C信号通路之间的相互作用。
主要实验方法及结果
01
ALKBH5的损失是PC的特征,具有预测疾病和预后的价值
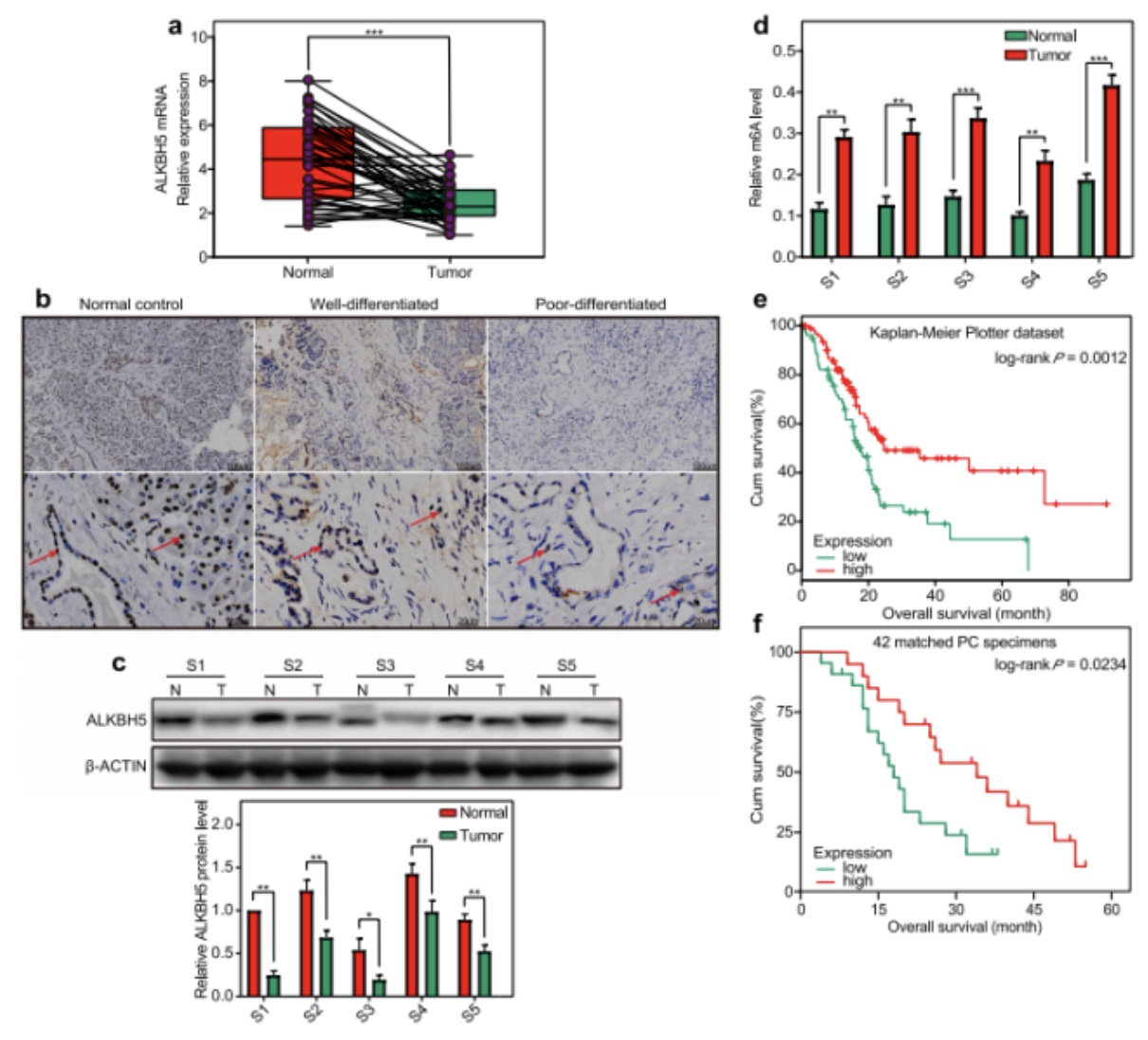
图1. m6A去甲基化酶ALKBH5的下调是胰腺癌的特征
作者首先分析了42个PC样本的临床表现(IHC-图1/b,WB-图1/c,RT-qPCR-图1/d),结果发现ALKBH5在PC患者的样本中表达量均低,且这些低表达量的样本中m6A的水平较高。图1/e使用Kaplan-Meier Plotter进行了生存曲线分析,结果显示ALKBH5低表达的患者预后较差。
02
ALKBH5可抑制PC细胞增殖、迁移和侵袭,并且可以让细胞滞留在G2/M期(体外实验)
为了确定ALKBH5依赖的m6A去甲基化的作用,作者分别对敲除/过表达ALKBH5基因的细胞进行了多角度的分析:
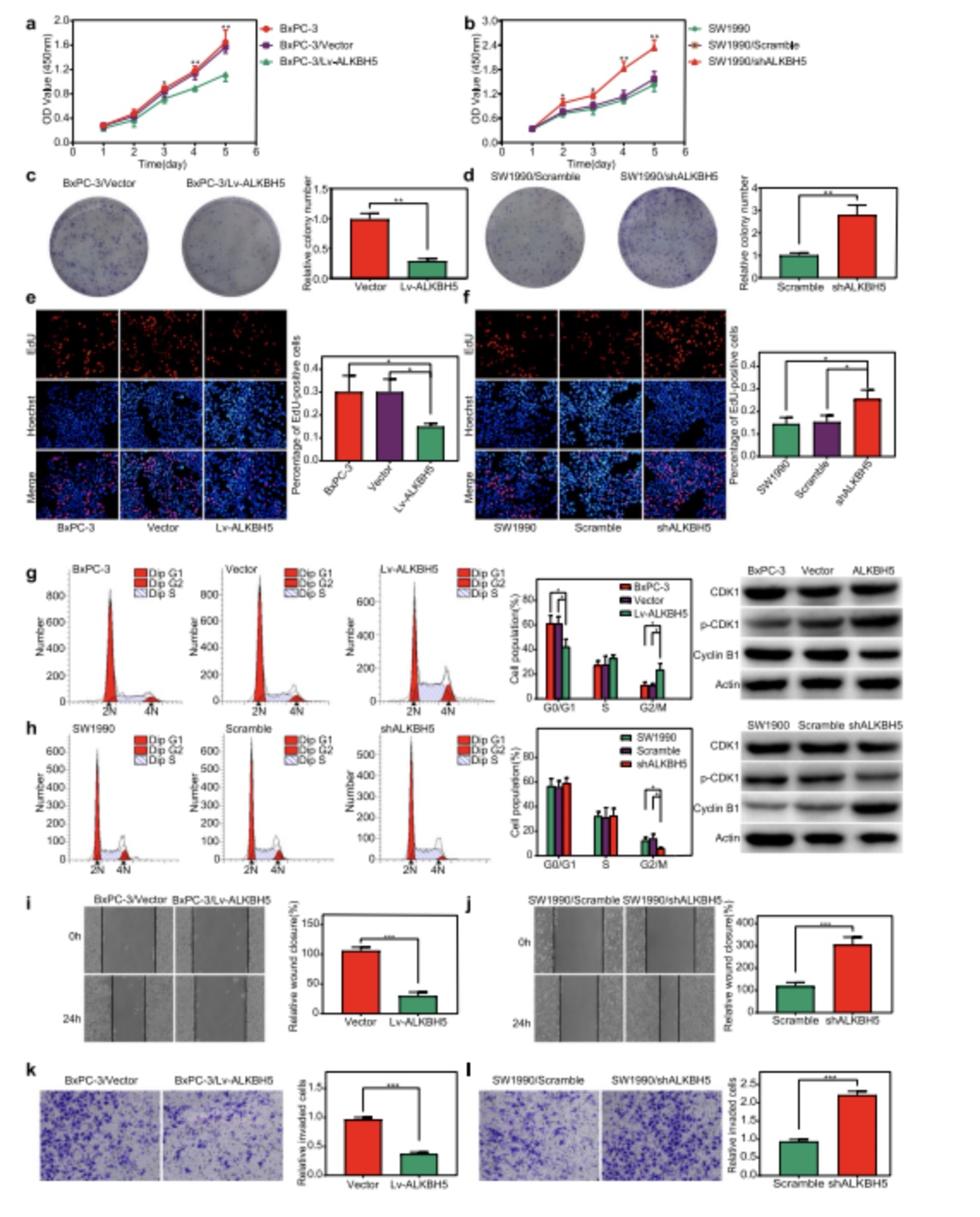
图2. ALKBH5对PC细胞的增殖、细胞周期、迁移和侵袭的抑制作用
(1)使用商业化的细胞增值检测盒(CCK-8、EdU)来评估PC细胞的增殖活性(图2/a,e),结果显示ALKBH5的过表达可以显著地减少PC细胞的增殖;利用菌落形成试验(Colony formation assays)也可以观察到ALKBH5的过表达削弱了PC细胞菌落的长期形成,ALKBH5的敲除则呈现了相反的结果;
(2)作者将流式细胞术和WB实验进行结合(图2/g,h),观察到ALKBH5的过表达(Lv-ALKBH5组)导致BxPC-3细胞在G2/M期的百分比显著增加,而ALKBH5的下调(shakbh5组)使得G2/M期细胞数量明显减少;
(3)在单层PC细胞上进行伤口愈合试验和transwell实验分别来评估PC细胞的迁移和侵袭能力(图2/i,j,k,i),结果显示ALKBH5的过表达会抑制PC细胞的这两种能力。
03
ALKBH5可抑制PC的生长和转移(体内实验)
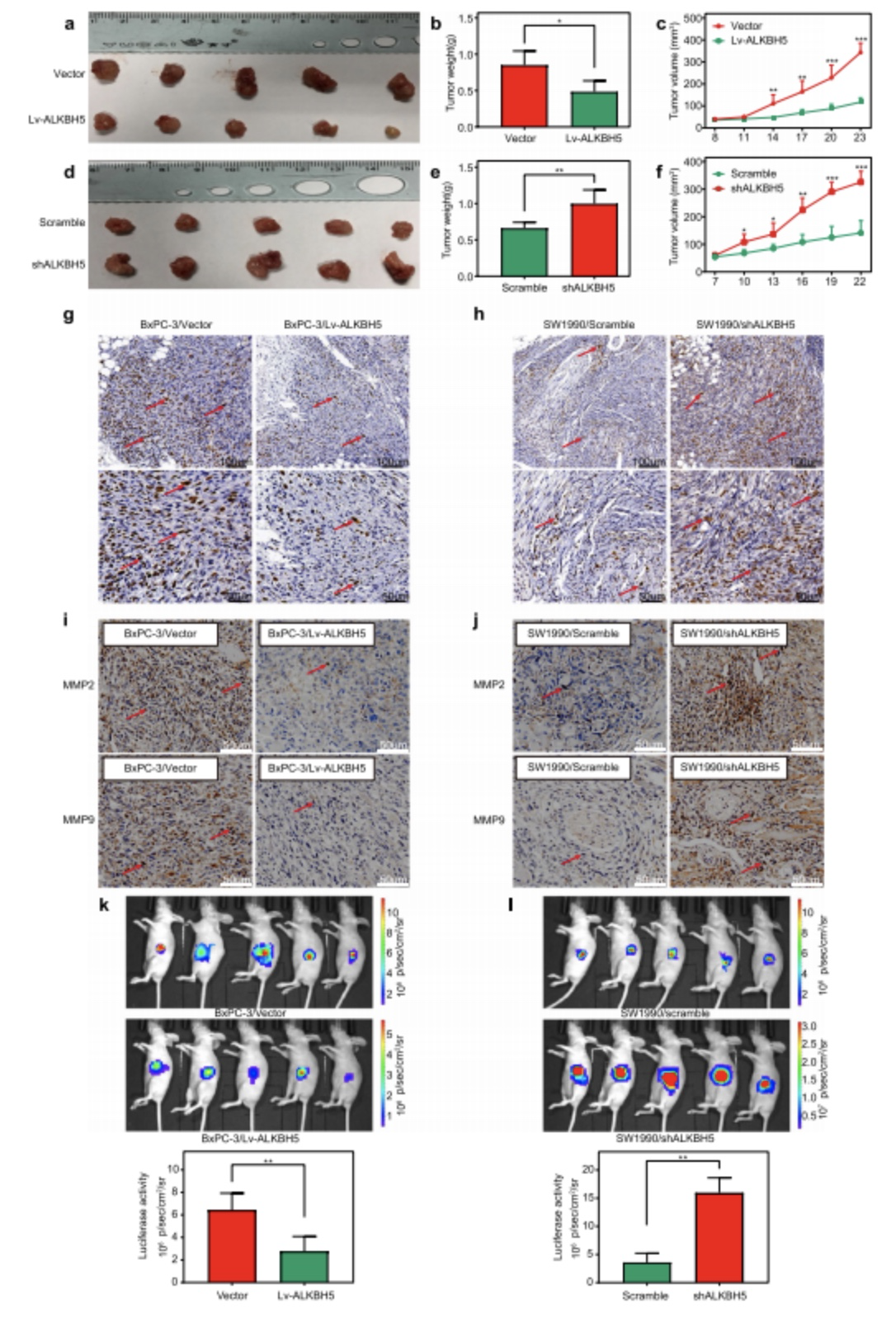
图3. ALKBH5抑制PC模型的肿瘤生长和侵袭潜能
作者接着构建了ALKBH5敲减/过表达的异种移植瘤小鼠模型和原位瘤小鼠模型,通过形态学、IHC和生物发光呈象(BLI)等角度进行了分析。
(1)与低表达ALKBH5的PC组织相比,过表达的肿瘤组织的质量有着明显的下降(图/a,c,d,f);
(2)免疫组化实验结果显示,ALFBH5过表达会造成ki-67(体内实验中细胞生长的关键指标之一),MMP-2 和 MMP-9的下调,而ALFBH5的敲除则会造成反效果(图/g,h,i,j);
(3)使用BLI技术在原位瘤小鼠模型中研究发现,植入BxPC-3/Lv-ALKBH5细胞的裸鼠荧光素酶活性明显低于植入BxPC-3/载体细胞的裸鼠;携带SW1990/shALKBH5细胞的小鼠荧光素酶信号明显高于携带SW1990/scramble细胞的小鼠(图/k,l)
04
ALKBH5的靶基因是PER1,且ALKBH5以m6A - YTHDF2依赖的方式增加PER1 mRNA的水平
为了进一步确认ALKBH5对PC细胞的转录谱是怎么影响的,作者对总共367个差异表达的基因(有204个上调的基因,163个下调的基因)进行了RNA-seq分析。GO和KEGG的结果均表明了,在ALKBH5过表达的PC细胞中,那些会造成细胞凋亡的基因均为上调基因,而那些造成细胞生存和增值的基因为下调基因(图4)。这些结果表明了ALKBH5可能通过影响基因转录参与调节PC。
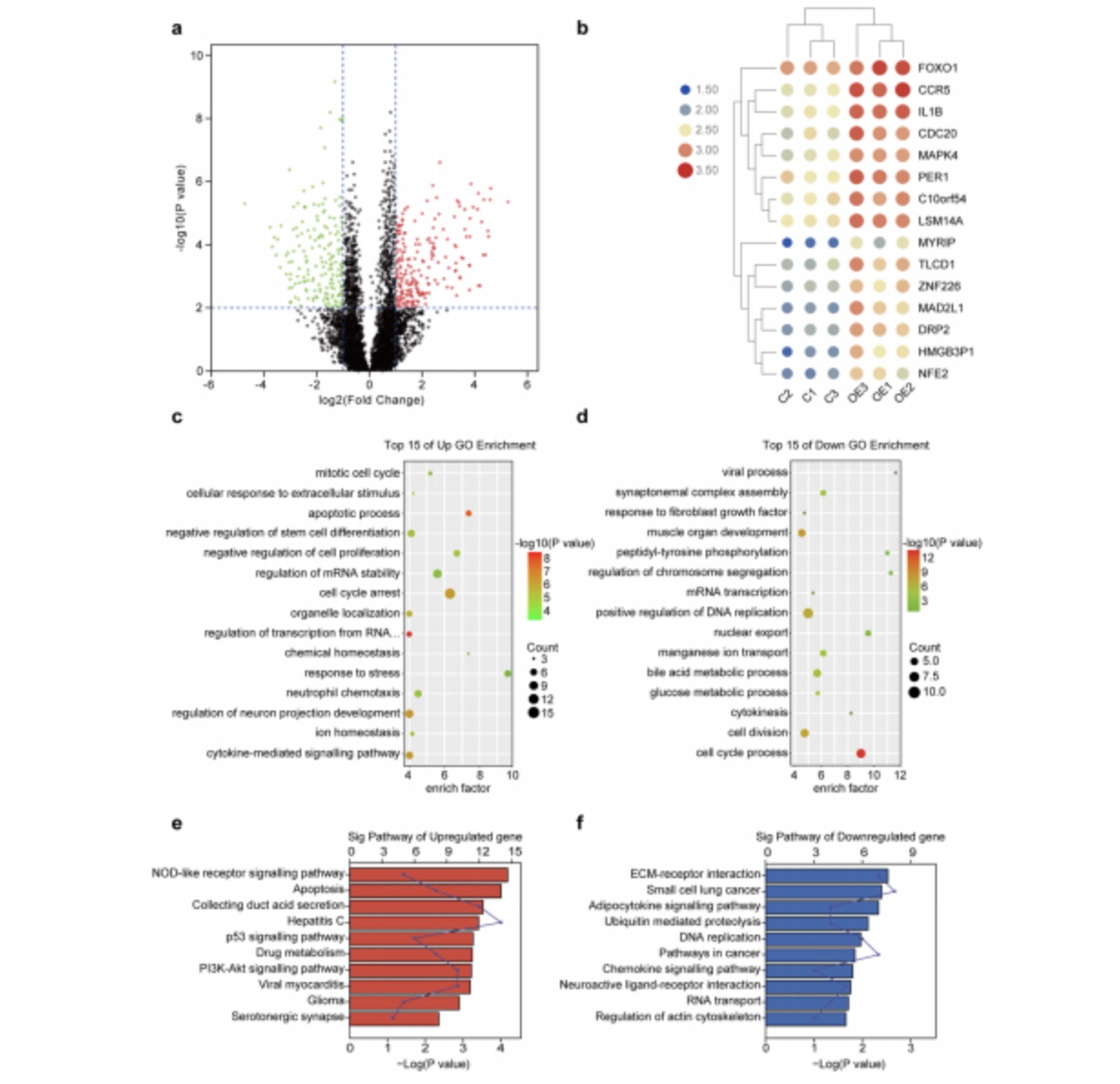
图4. ALKBH5对PC细胞转录谱的影响
作者在整体分子水平上对ALKBH5进行了分子调控可能性的分析之后,又进行了m6A-seq的测序,以确定ALKBH5的潜在靶基因。作者总共筛选出了9个高甲基化的靶基因(图5/e),其中发现PER1 mRNA的3 ' -UTR中有一个m6A峰值的富集,该峰值在ALKBH5的过表达降低后减少(图5/f),这暗示了ALKBH5是可能的靶基因。
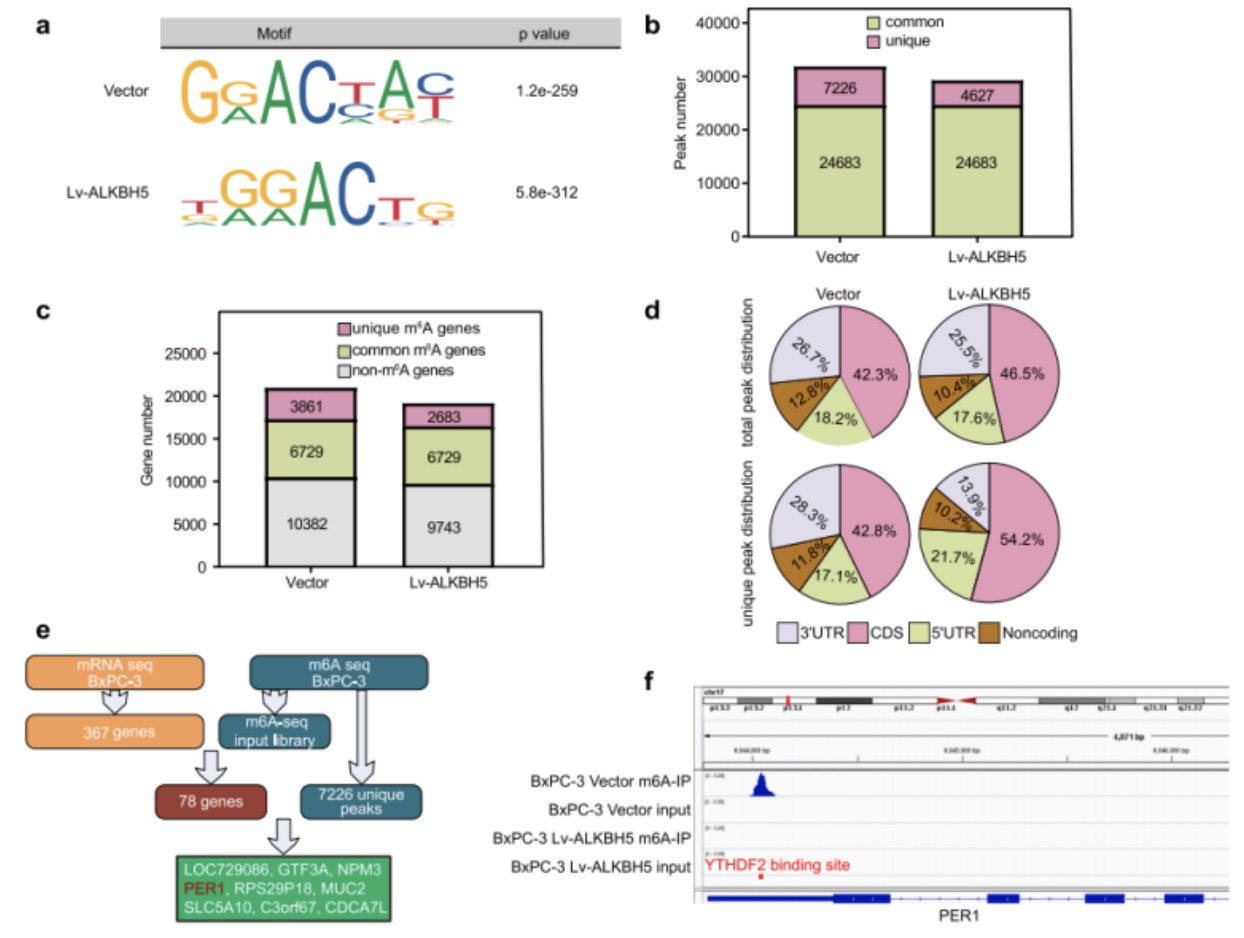
图5. m6A甲基化是ALKBH5起作用的基础
为了进一步确认PER1是ALKBH5的靶基因,作者对ALKBH5基因进行了敲除和过表达,结果显示敲除后的PC细胞显示低的PER1甲基化水平,而过表达后的PC细胞则显示高的PER1甲基化水平(图6/a)。通过MeRIP-qPCR实验,证明了ALKBH5可调控PER1的mRNA水平及m6A甲基化水平(图6/b)。对PER1进行序列分析后,PER1 mRNA中的m6A修饰位点位于YTHDF2结合位点附近(图5/f);在敲低YTHDF2后,PC细胞中PER1 mRNA的水平上升(图6/e)。因此,ALKBH5被认为通过消除m6A- YTHDF2依赖的mRNA降解来增加PER1 mRNA水平。
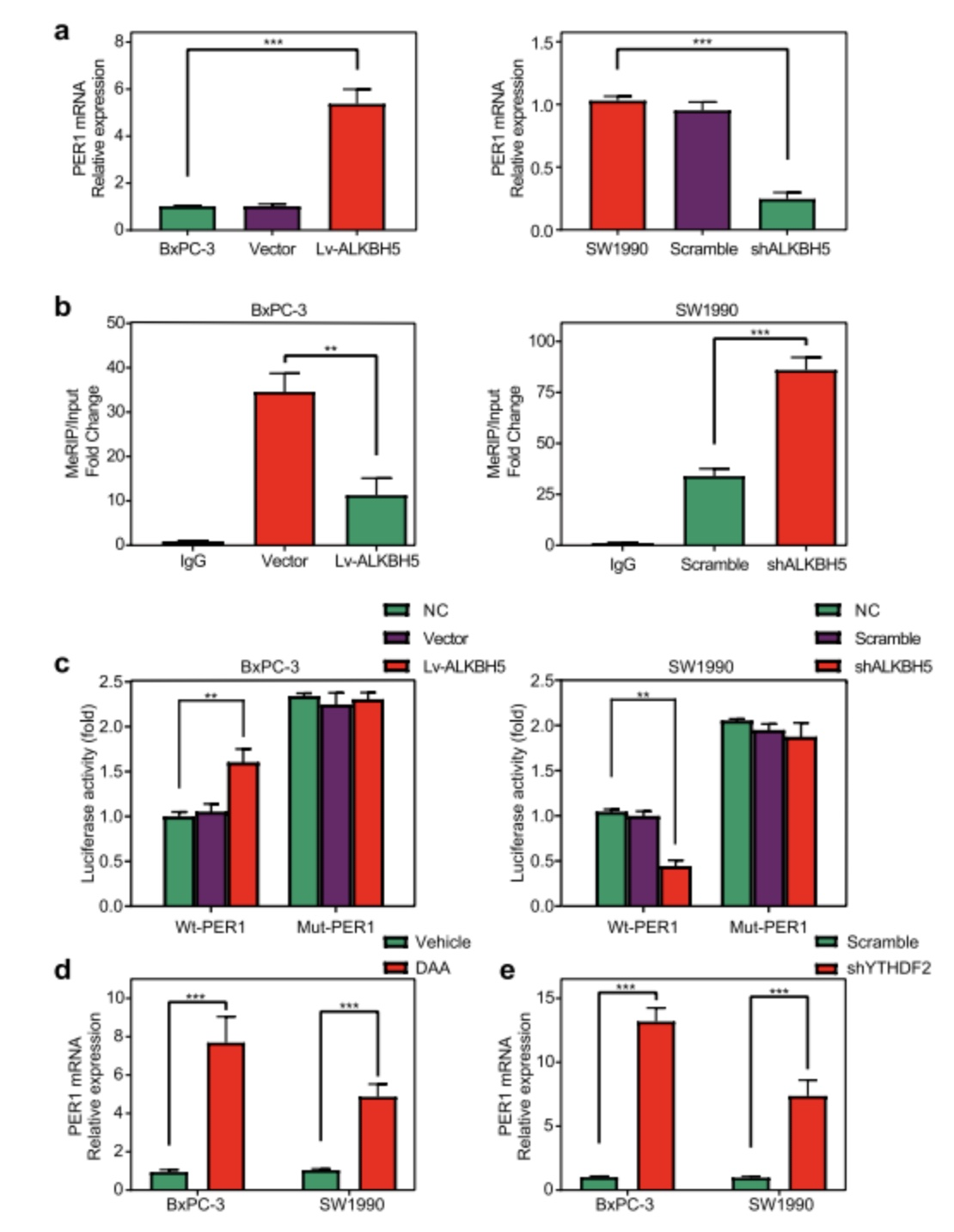
图6. ALKBH5以m6A - YTHDF2依赖的方式增加PER1 mRNA水平
05
靶基因PER1对PC有抑制作用
在确定了ALKBH5的靶基因是PER1之后,作者又对PER1的生物学功能进行了分析。
(1)42个临床样本分析发现,PC患者组织中PER1基因有所上调;
(2)通过免疫荧光实验发现,可发现PER1的过表达可以减少因ALKBH5的敲除而引起的细胞形态上的变化,证明了PER1和ALKBH5的表达为正相关(图7/e);
(3)细胞增值检测盒(CCK-8、EdU)和transwell检测证实,PER1的异位表达抑制了PC的进展,并部分挽救了ALKBH5基因下调后PC细胞增殖和侵袭过程中观察到的异常状态(图7/f,g,h);
(4)WB实验结果显示,在PER1缺失的前提下(敲除ALKBH5引起的),G2/M期细胞周期阻滞基因的下调和CYCLIN B1的上调,而PER1的过表达部分逆转了这些异常,证实了正常表达的PRE1可以重新激活ATM的相关信号通路(图7/i);
(5)CoIP实验则进一步证实了PER1和ATM之间的关系(图7/j)
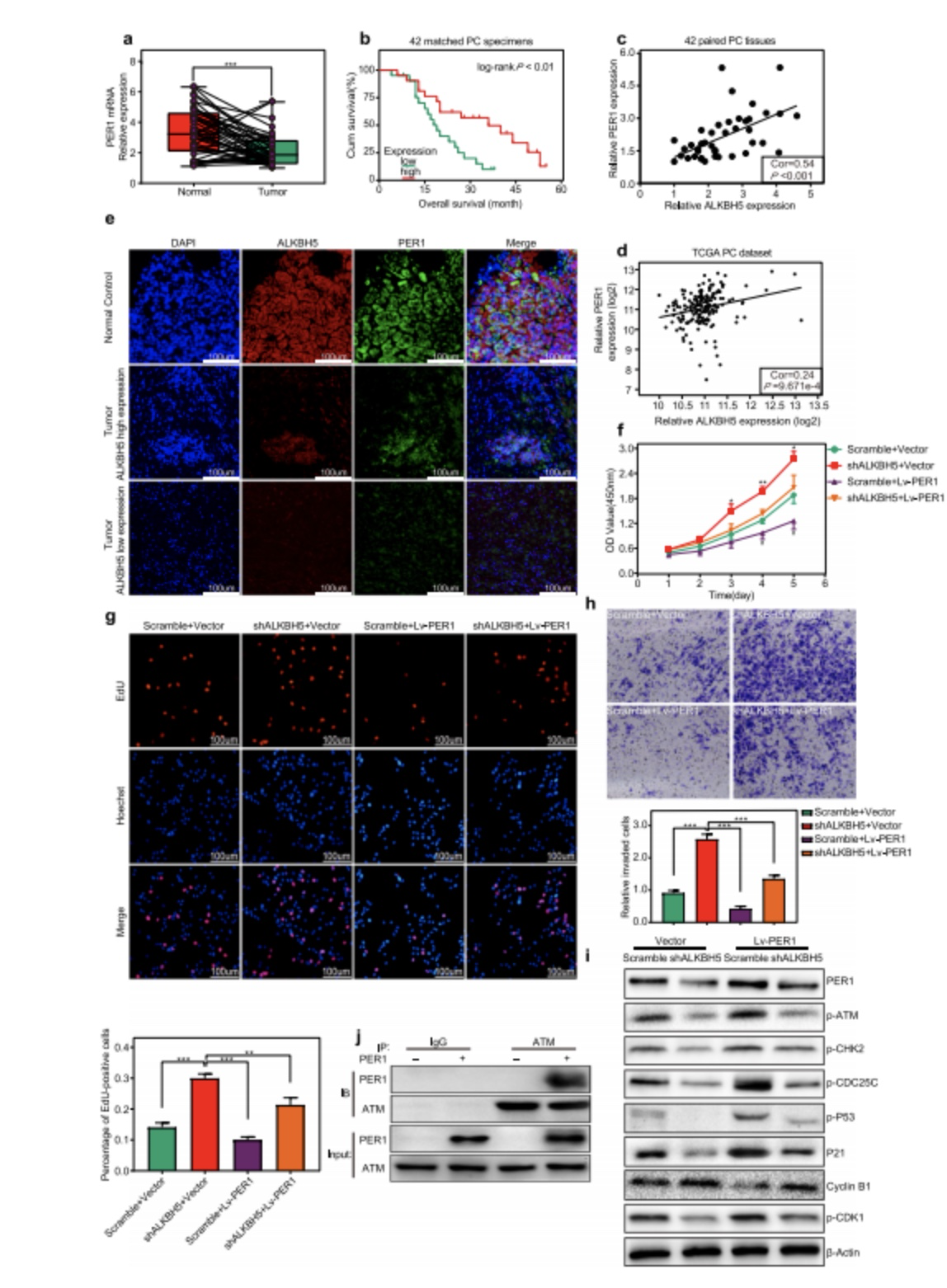
图7. ALKBH5与PC组织中PER1表达相关,具有抑癌的作用
06
PER1通过诱导P53从而恢复ALKBH5转录的上调
(1)P53(与ATM相关的基因之一)的异位表达使得PC细胞中ALKBH5的水平有了显著地提高(图8/a,b);
(2)同时免疫荧光实验结果也显示了P53的表达降低了PC细胞中RNA的甲基化水平(图8/c);
(3)接着作者设计了两段引物用于覆盖P53两段的结合位点,并在转录了P53基因的PC细胞中进行ChIP实验,发现P53能与两个位点结合,其中绝大多数结合在位点1(图8/e);
(4)进一步进行荧光素酶的检测发现P53通过野生型启动子刺激ALKBH5的表达,而这种效应则被位点1或位点2的突变所抵消(图8/f,g)。
以上实验均证实了PER1可以通过P53基因来控制ALKBH5的转录
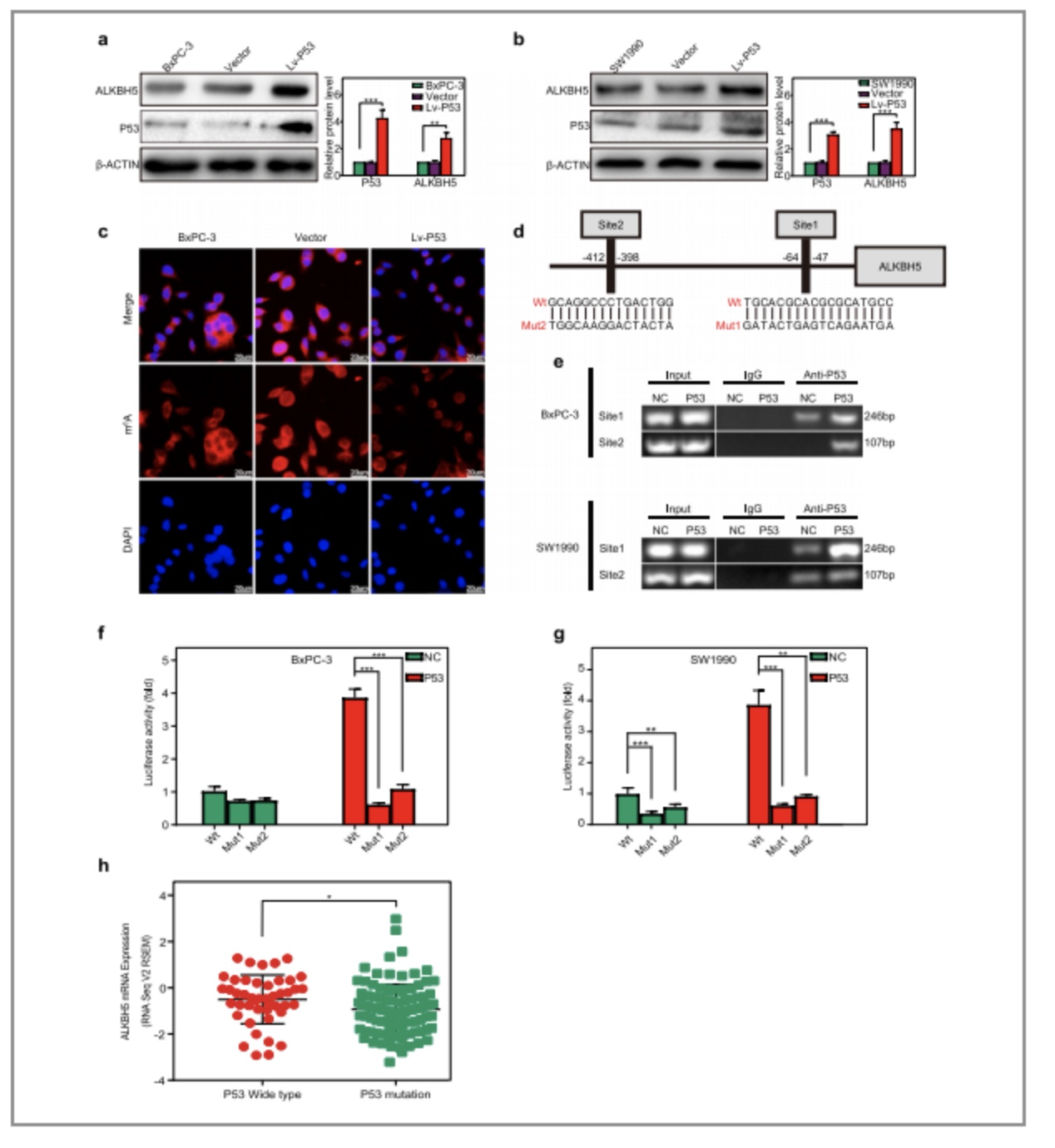
图8. per1通过诱导P53反馈调节ALKBH5的转录
结论
ALKBH5作为PC的抑制因子,可通过m6A的消亡来调节PER1的转录后激活,这为后续的基于去甲基化来进行PC诊断和治疗的研究提供了更多可能性。
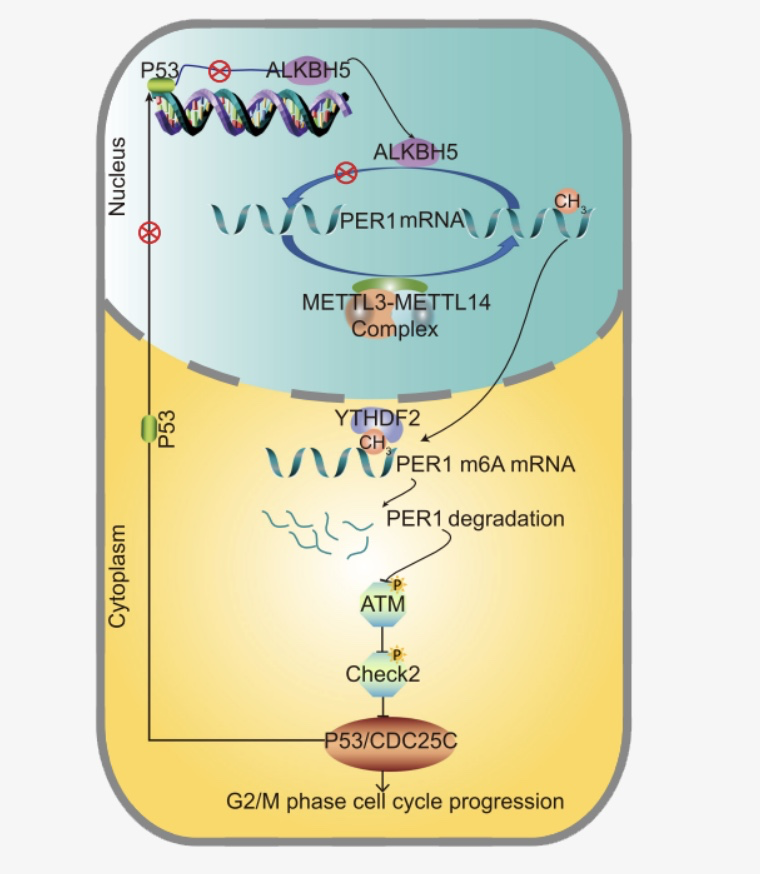
图9. ALKBH5诱导PER1转录后激活,以m6A- YTHDF2依赖的方式抑制PC进展

